La conduttività equivalente a diluizione infinita di una soluzione è data dalla somma della mobilità del catione e dell’anione che non si influenzano tra loro
Il massimo valore assunto dalla conduttività equivalente della soluzione di un elettrolita è detta conduttività equivalente limite o conduttività equivalente a diluizione infinita e viene simboleggiata con Λo.
Il valore di Λo è caratteristico per ciascun elettrolita ed esso è raggiunto quando la sua dissociazione nella soluzione è completa ovvero il grado di dissociazione α è pari a 1.
Elettroliti forti
Se l’elettrolita è forte il suo grado di dissociazione è uguale a 1 già in soluzioni mediamente diluite. Pertanto aumentando la diluizione diminuisce subito la conduttività specifica χ ovvero il numero di ioni per cm3
Tuttavia aumenta in egual misura Veq a causa dell’aggiunta del solvente e quindi la conducibilità equivalente Λo rimane costante.
Si ricordi che la conducibilità equivalente Λo è data dal prodotto χ Veq.
[irp posts=”3428″ ]
Elettroliti deboli
Se invece l’elettrolita è debole il suo grado di dissociazione è minore di 1 anche in soluzioni molto diluite. Pertanto aggiungendo il solvente inizialmente aumenta sia χ ( in quanto aumenta il numero di ioni presenti per cm3) sia Veq
Quindi si ha un aumento della conduttività equivalente della soluzione.
Continuando a diluire la soluzione anche l’elettrolita debole si dissocia del tutto. La diminuzione di χ provocata dall’ulteriore diluizione è compensata dall’aumento di Veq
Pertanto da questo momento in poi la conduttività equivalente Λo rimane costante.
Consideriamo, a titolo di esempio, soluzioni di tre elettroliti e precisamente HCl (acido forte), CH3COOH (acido debole) e KCl (sale forte) aventi la stessa concentrazione.
La conduttività equivalente limite della soluzione di HCl è maggiore di quella limite dell’acido acetico. Infatti, sebbene a diluizione infinita sia uguale il numero di ioni totali liberati dai due elettroliti, la mobilità dell’anione Cl– è maggiore rispetto a quella dello ione CH3COO–
Inoltre Λo dell’acido acetico è maggiore rispetto a quella di KCl poiché la mobilità dello ione H+ è maggiore rispetto a quella di tutti gli altri ioni.
Per le soluzioni di elettroliti forti si verifica una piccola variazione della conduttività in funzione della diluizione. Il valore di Λo può essere ottenuto tramite estrapolazione grafica dei dati sperimentali ottenuti con soluzioni sempre più diluite dell’elettrolita. Al contrario, le soluzioni di elettroliti deboli mostrano una elevata variazione positiva della conduttività equivalente quando aumenta la diluizione. Pertanto il valore di Λo non può essere ottenuto per estrapolazione in un grafico in cui è riportata la conduttività equivalente di alcuni elettroliti in funzione della concentrazione espressa con la radice quadrata della normalità.
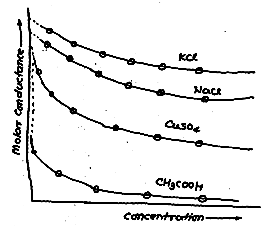 Dal grafico si vede che è possibile ottenere Λo per gli elettroliti forti mediante estrapolazione grafica (linea tratteggiata). La stessa cosa non è possibile per l’acido acetico che è caratterizzato da forti variazioni di conduttività ad elevate diluizioni. Ciò si verifica al tendere a zero della concentrazione dell’elettrolita.
Dal grafico si vede che è possibile ottenere Λo per gli elettroliti forti mediante estrapolazione grafica (linea tratteggiata). La stessa cosa non è possibile per l’acido acetico che è caratterizzato da forti variazioni di conduttività ad elevate diluizioni. Ciò si verifica al tendere a zero della concentrazione dell’elettrolita.
Legge dell’indipendente mobilità degli ioni
Tale difficoltà fu superata con la “legge dell’indipendente mobilità degli ioni” dedotta da Kohlrausch.
Lo scienziato notò sperimentalmente che la differenza tra i valori di Λo di soluzioni di elettroliti forti, aventi in comune lo stesso catione, ovvero lo stesso anione, era costante nello stesso solvente e alla medesima temperatura. Ciò implicava l’assenza di reciproche interazioni.
A 25°C i valori della conduttività equivalente limite ottenuta per estrapolazione grafica dei due elettroliti forti KNO3 e NaNO3 (aventi in comune lo ione nitrato) sono:
Λo KNO3 = 144.96
Λo NaNO3 = 121.55
La differenza tra tali valori corrisponde a 23.41. Consideriamo altri due elettroliti forti aventi in comune lo stesso anione, ma con gli stessi due cationi degli elettroliti precedenti e precisamente K+ e Na+. Si deve avere per confermare la veridicità della legge dell’indipendente mobilità degli ioni che la differenza delle conduttività ioniche equivalenti a diluizione infinita deve essere la stessa. Infatti, dai risultati sperimentali si ottiene, per estrapolazione, che
Λo KF = 128.92
Λo NaF =105.51
La cui differenza dà nuovamente lo stesso valore corrispondente a 23.41
A diluizione infinita quindi le conduttività equivalenti non risentono dell’effetto di interazione degli ioni presenti in soluzione. Ciò è dovuto alla elevata distanza alla quale si trovano gli ioni che impedisce agli stessi interazioni elettrostatiche di tipo coulombiano. La legge afferma che” la conduttività equivalente a diluizione infinita della soluzione di un elettrolita è data dalla somma della mobilità del suo catione (lo+) e del suo anione (lo–)” che, in tali condizioni non si influenzano reciprocamente.
