Le leggi ponderali sono una serie di principi fondamentali che descrivono le relazioni quantitative tra le masse dei reagenti e dei prodotti in una reazione chimica. Le leggi ponderali attengono la chimica classica e si riferiscono agli aspetti quantitativi delle masse di diversi elementi che si combinano per formare altri composti nelle reazioni chimiche.
Sono le prime leggi della chimica costituendo una innovazione nel campo dello sviluppo della scienza e il loro nome deriva dal latino pondus che significa peso. Si tenga presente che all’epoca della formulazione delle leggi ponderali gli scienziati del tempo non avevano altro che una bilancia per i loro esperimenti.
Sono quelle che hanno dimostrato che le masse di sostanze che reagiscono non lo fanno in modo arbitrario o casuale ma mantenendo un rapporto matematico costante di numeri interi o sottomultipli di essi, in cui gli atomi degli elementi non vengono né creati né distrutti.
Le leggi ponderali sono innovative rispetto alla chimica del tempo in quanto hanno fornito un quadro sistematico e quantitativo per comprendere le reazioni chimiche. Prima della loro formulazione la chimica era spesso basata su osservazioni qualitative e processi empirici. Esse hanno quindi introdotto un approccio scientifico e matematico nello studio delle reazioni chimiche.
La prima delle leggi ponderali
Antoine Lavoisier formulò la legge di conservazione della massa intorno al 1774-1775, durante i suoi studi sulle reazioni chimiche e la combustione. Nel 1789, Lavoisier pubblicò i suoi risultati nel suo famoso trattato “Traité élémentaire de chimie” in cui enunciò la legge di conservazione della massa che è uno dei principi fondamentali della chimica.
Tale legge, detta Legge di Lavoisier, afferma che la massa totale dei reagenti e dei prodotti rimane costante durante una reazione ovvero “nulla si crea, nulla si distrugge, tutto si trasforma”
La legge di conservazione della massa di Lavoisier ha rivoluzionato il modo in cui le persone comprendevano le trasformazioni chimiche.
Fu accolta inizialmente con scetticismo da alcuni scienziati e chimici del suo tempo infatti la sua affermazione secondo cui la massa fosse conservata durante una reazione chimica sfidava le credenze consolidate dell’epoca.

Questa legge contraddiceva l’antico concetto della “transmutazione dei metalli” e la teoria del flogisto. Tuttavia, col passare del tempo e con il sostegno di prove sperimentali convincenti, la legge di Lavoisier fu progressivamente accettata e riconosciuta come uno dei pilastri fondamentali della chimica moderna. Le sue scoperte furono alla base della rivoluzione chimica del XVIII secolo e aprirono la strada ad un approccio scientifico
Legge di Proust
Joseph Louis Proust formulò la legge delle proporzioni definite che è, in ordine di tempo la seconda delle leggi ponderali, intorno al 1794-1799. Durante i suoi studi sulle composizioni chimiche, Proust osservò che una data sostanza chimica è sempre composta da elementi in una proporzione definita in massa, indipendentemente dalla sua origine o preparazione.
Proust pubblicò i suoi risultati nel 1799 nel suo lavoro intitolato “Éléments de chimie” in cui enunciò la legge delle proporzioni definite come un importante principio nella chimica. La legge delle proporzioni definite di Joseph Louis Proust fu accolta inizialmente con un certo grado di scetticismo da alcuni dei suoi contemporanei.
La sua affermazione secondo cui una sostanza chimica fosse sempre composta da elementi in una proporzione definita in massa andava contro le concezioni tradizionali dell’epoca.
Alcuni chimici dell’epoca, tra cui Claude Louis Berthollet, sostennero l’idea che le proporzioni chimiche potessero variare e non fossero necessariamente fisse.
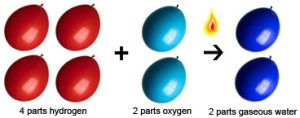
Tuttavia, nel corso del tempo, la legge di Proust ricevette un supporto sempre maggiore da parte di altri scienziati e chimici che effettuarono esperimenti e raccolsero prove a sostegno della sua legge. Evidenze sperimentali convincenti raccolte da altri chimici, come John Dalton, contribuirono a consolidare la validità della legge di Proust.
Legge delle proporzioni multiple
Secondo la legge delle proporzioni multiple che è l’ultima delle leggi ponderali “se due elementi si combinano tra loro per dare più di un composto, le quantità in peso di uno, che si combinano con una quantità fissa dell’altro, stanno tra loro in rapporti esprimibili mediante numeri interi, generalmente piccoli”
Tale legge fu formulata da John Dalton intorno al 1803. I risultati dei suoi studi furono pubblicati in un lavoro intitolato “A New System of Chemical Philosophy” nel 1803. La legge delle proporzioni multiple di Dalton contribuì alla sua teoria atomica, che considerava gli atomi come le unità fondamentali della materia e spiegava come gli elementi si combinassero tra loro in modo specifico.

La teoria atomica di Dalton costituisce la prima e organica interpretazione che si cimenta con la struttura della materia in termini atomico-molecolari. Le teorie di Dalton hanno portato a un cambiamento fondamentale nella concezione della materia in contrasto con le idee precedenti.
La legge delle proporzioni multiple di Dalton e la sua teoria atomica hanno avuto un impatto significativo sulla comprensione delle combinazioni chimiche fornendo una base solida per il progresso successivo della chimica che ora estende i suoi orizzonti dalla chimica verde alla click chemistry.
Dalla fine del XVIII secolo la chimica ha svolto un ruolo cruciale nel miglioramento della vita degli uomini, affrontando problemi globali e portando a nuove scoperte per un futuro migliore.
