Il gruppo ossidrilico è un gruppo composto da un atomo di ossigeno legato a un atomo di idrogeno. È comunemente trovato in diverse classi di composti inorganici e organici ed è responsabile delle proprietà chimiche e fisiche di molte sostanze.
La presenza del gruppo ossidrilico può influenzare le proprietà fisiche di un composto, come il punto di ebollizione, il punto di fusione e la densità. È un gruppo che forma un legame polare a causa della differenza di elettronegatività tra l’atomo di ossigeno e l’atomo di idrogeno.
Ciò significa che l’ossigeno ha una parziale carica negativa (δ–) mentre l’idrogeno ha una parziale carica positiva (δ+). Pertanto i composti in cui esso è contenuto formano legami a idrogeno. Quando le molecole polari contenenti il gruppo ossidrilico si avvicinano tra loro l’idrogeno sarà attratto dall’elemento più elettronegativo dell’altra molecola.
Questo tipo di legame, che è il più forte dei cosiddetti legami secondari, è responsabile dei punti di ebollizione delle molecole in cui esso si verifica. Pertanto, a parità di massa molare, le molecole contenenti il gruppo ossidrilico hanno una temperatura di ebollizione più alta.
Molti composti contenenti il gruppo ossidrilico sono solubili in acqua a causa della capacità del gruppo -OH di formare legami idrogeno con le molecole d’acqua. Tuttavia, la solubilità può variare a seconda delle dimensioni e della struttura complessiva del composto.
Composti inorganici e gruppo ossidrilico
I tipici composti inorganici contenenti il gruppo -OH sono gli idrossidi metallici. Queste specie che derivano dalla reazione tra un ossido basico e acqua, sono denominate basi.
Secondo la definizione di Arrhenius le basi sono sostanze in grado di liberare ioni OH–.

Alcuni degli idrossidi inorganici, come l’idrossido di sodio, l’idrossido di calcio e altri idrossidi alcalini, sono basi forti che hanno importanti usi nel campo industriale.
Alcuni di essi, come l’idrossido di zinco, alluminio, stagno, berillio e piombo, sono idrossidi anfoteri, poiché agiscono sia come acidi che come basi. Ad esempio l’idrossido di alluminio si comporta da base quando reagisce con un acido.
Si comporta da base reagendo con acido cloridrico per formare cloruro di alluminio e acqua:
Al(OH)3 + 3 HCl → AlCl3 + 3 H2O
mentre si comporta da acido in soluzioni basiche formando il tetraidrossoalluminato:
Al(OH)3 + OH– → Al(OH)4–
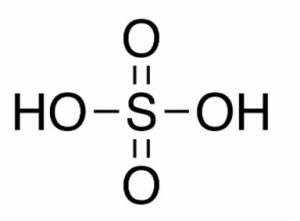
Altri composti inorganici contenenti il gruppo ossidrilico sono gli ossiacidi ovvero acidi ternari che contengono nella loro struttura molecolare atomi di idrogeno, di un non metallo e di ossigeno.
Un esempio è costituito dall’acido solforico che contiene lo zolfo con numero di ossidazione +6 legato, tramite legame doppio rispettivamente a due atomi di ossigeno e a due gruppi ossidrilici
Composti organici e gruppo ossidrilico
Alcoli, fenoli e acidi carbossilici sono tre tipi di composti organici contenenti il gruppo ossidrilico. Gli alcoli sono composti organici caratterizzati dalla presenza del gruppo funzionale –OH legato a un atomo di carbonio e hanno bassa acidità. Essi sono acidi più deboli rispetto all’acqua.
Infatti mentre i valori di pKa degli alcoli sono in genere compresi tra 15 e 20 il valore di pKw dell’acqua è di 14
L’equilibrio acido base di un alcol può essere rappresentato come:
R-OH + OH– ⇌ R-O– + H2O
essendo R-O– lo ione alcossido, base coniugata dell’alcol.

Nei fenoli la maggiore acidità è dovuta al fatto la base coniugata è stabilizzata per risonanza.
Nelle reazioni di sostituzione nucleofila il gruppo -OH non è un buon gruppo uscente pertanto affinché un alcol dia luogo a reazioni di sostituzione nucleofila è necessario che sia trasformato in un miglior gruppo uscente in presenza di un acido forte secondo la reazione :
R-OH + H+ → R-OH2+ in cui si ottiene il gruppo –-OH2+ che è un buon gruppo uscente.
Quando il gruppo –OH è stato trasformato in un buon gruppo uscente gli alcoli possono dar luogo a reazioni di sostituzione nucleofila o di ß-eliminazione.
Se l’alcol è secondario o terziario il meccanismo di sostituzione nucleofila avviene via SN1 ovvero con formazione del carbocatione terziario come intermedio di reazione e si ottiene, come prodotto di reazione una miscela racemica nel caso in cui il carbonio legato al gruppo -OH sia chirale
Reazioni
Il gruppo ossidrilico può agire come nucleofilo in molte reazioni organiche. Un esempio è costituito dalla saponificazione degli esteri che avviene in ambiente basico e porta alla formazione di uno ione carbossilato e un alcol.
Un’altra reazione in cui il gruppo -OH ha un ruolo fondamentale è l’idrolisi delle ammidi da cui si ottiene uno ione carbossilato e ammoniaca.
In ambiente basico si verifica la reazione di Cannizzaro in cui un’aldeide non enolizzabile dà luogo alla formazione di un alcol primario e uno ione carbossilato.
Il gruppo ossidrilico è presente, come legante, in molti composti di coordinazione come, ad esempio il tetraidrossizincato Zn(OH)42- oltre al già citato Al(OH)4–
