L’acido cianurico (CYA) è un composto con formula (CNOH)3 utilizzato nelle piscine proteggendo il cloro presente dalla luce solare. I raggi ultravioletti del sole degradano, infatti, il cloro molto rapidamente. La luce solare, infatti, può eliminare il cloro del 75-90% nel giro di due ore.
Struttura
L’acido cianurico è una triazina ovvero un composto organico simile al benzene in cui tre atomi di carbonio sono sostituiti da tre atomi di azoto. In esso, nella struttura della triazina sono presenti tre gruppi -OH e il suo nome I.U.P.A.C. è 1,3,5-triazin-2,4,6-triolo.
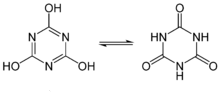
Può essere visto come il trimero ciclico dell’acido cianico e va incontro a tautomeria cheto-enolica. Sebbene la forma chetonica non abbia carattere aromatico è quella che prevale in soluzione.
Proprietà
È una polvere cristallina di colore bianco scarsamente solubile in acqua.
È solubile in acido solforico, dimetilformammide, idrossido di sodio, idrossido di potassio e dimetilsolfossido.
Esso è abbastanza solubile in acetone, benzene, etere etilico, etanolo ed esano. Si presenta poco solubile in metanolo freddo e cloroformio.
Una soluzione satura di acido cianurico ha un pH tra 3.8 e 4.0
Sintesi
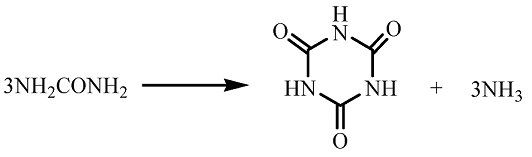
Il chimico tedesco Friedrich Wöhler nel 1829 ottenne l’acido cianurico sua dalla decomposizione termica dell’urea:
Acido cianurico e piscina
Per eliminare il rischio della presenza di agenti patogeni è necessario introdurre nelle piscine un agente disinfettante. Il più comune è il cloro messo sotto forma di ipoclorito di calcio Ca(ClO)2 e ipoclorito di sodio NaClO. Entrambi i sali sono solubili in acqua e si dissociano dando lo ione ipoclorito che, in acqua, dà reazione di idrolisi secondo l’equilibrio:
ClO– + H2O ⇆ HClO + OH–
L’acido ipocloroso HClO uccide batteri ed altri agenti patogeni. Esso attacca i lipidi delle pareti cellulari distruggendo gli enzimi e le strutture interne alla cellula tramite una reazione di ossidazione.
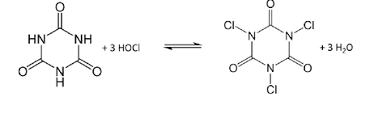
Un problema che si presenta con l’uso degli ipocloriti è che l’acido ipocloroso non è molto stabile e può degradarsi in presenza della luce U.V.
Onde evitare questo fenomeno spesso i disinfettanti sono preparati in commercio con stabilizzanti come l’acido cianurico che reagisce con l’acido ipocloroso per dare il clorocianurato più stabile
 Usi
Usi
È un intermedio chiave per la sintesi di una varietà di composti organici, tra cui resine epossidiche, derivati clorurati, detergenti, antiossidanti, coloranti, pesticidi