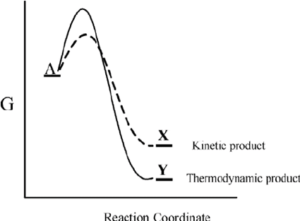
Il prodotto cinetico e il prodotto termodinamico si ottengono da alcune reazioni chimiche a seconda delle condizioni in cui avvengono. Immaginiamo una reazione in cui possono essere formati sia il prodotto X che il prodotto Y. Supponiamo che il diagramma della coordinata di reazione sia quello in figura:
Prodotto cinetico
Se per il prodotto X l’energia di attivazione EA è più bassa rispetto a quella del prodotto Y. Ciò implica che l’energia necessaria per ottenere il prodotto X è minore e quindi il prodotto Y si forma più rapidamente del composto B. Il prodotto A è detto prodotto cinetico della reazione .
Nel caso del prodotto Y l’energia di attivazione EB è maggiore rispetto a quella del prodotto X. Ciò implica che l’energia necessaria per ottenere il prodotto Y è maggiore e quindi il prodotto Y si forma più lentamente.
Prodotto termodinamico
Una volta che si è formato il prodotto Y l’energia della molecola è minore rispetto a quella del prodotto X. Il prodotto più stabile è detto prodotto termodinamico della reazione.
Quando una reazione dà luogo al prodotto cinetico in quantità maggiore si dice che è sotto il controllo cinetico. Invece se dà luogo in quantità maggiore al prodotto termodinamico si dice che è sotto il controllo termodinamico.
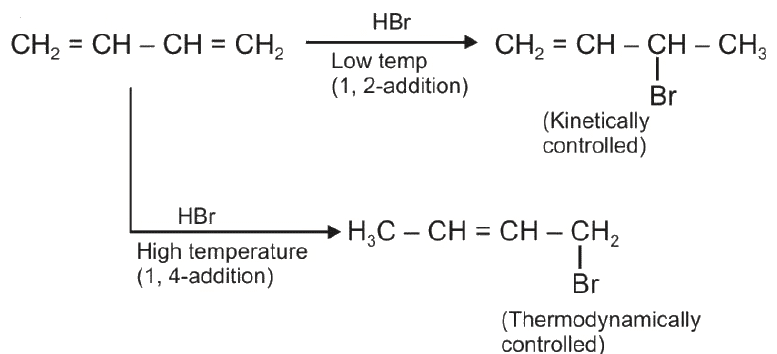
L’addizione elettrofila all’1,3-butadiene può dare due prodotti di reazione: il prodotto 1,2- che è il prodotto cinetico e il prodotto 1,4 che è quello termodinamico:
CH2=CH-CH=CH2 + HBr → CH3CHBr-CH=CH2 + CH3CH=CHCH2Br
Il prodotto di addizione 1,2- è il 3-bromo,1-butene (prodotto cinetico)
Il prodotto di addizione 1,4- è l’ 1-bromo, 2-butene (prodotto termodinamico)
Condizioni di reazione
Per un tale tipo di reazione il prodotto che si ottiene in maggiore quantità dipende dalle condizioni in cui avviene la reazione: se la reazione avviene a basse temperature ovvero in condizioni in cui la reazione è irreversibile allora il prodotto prevalente è quello cinetico. Ad esempio l’addizione tra l’1,3-butadiene e HBr se è condotta alla temperatura di – 80 °C dà luogo alla formazione del prodotto di addizione 1,2-.
Infatti nelle condizioni indicate il prodotto di addizione 1,2- si ottiene in ragione dell’80% mentre il prodotto di addizione 1,4- si ottiene in ragione del 20%.
Viceversa se la reazione viene condotta a temperature maggiori in condizioni per le quali possa essere considerata reversibile allora la situazione cambia: alla temperatura di 45°C il prodotto di addizione 1,2- si ottiene in ragione dell’15 % mentre il prodotto di addizione 1,4- si ottiene in ragione del 85%.
Il primo stadio della reazione è costituito, in entrambi i casi, dall’addizione di H+ al carbonio 1. Lo stadio che determina la formazione del prodotto è quindi il secondo stadio il cui il nucleofilo Br– può attaccare il carbonio 2 o il carbonio 4.
Poiché il prodotto di addizione 1,2- si forma più rapidamente lo stato di transizione per la sua formazione è più stabile rispetto allo stato di transizione per la formazione del prodotto 1,4-
Diagramma
Il diagramma della coordinata di reazione è rappresentato in figura:
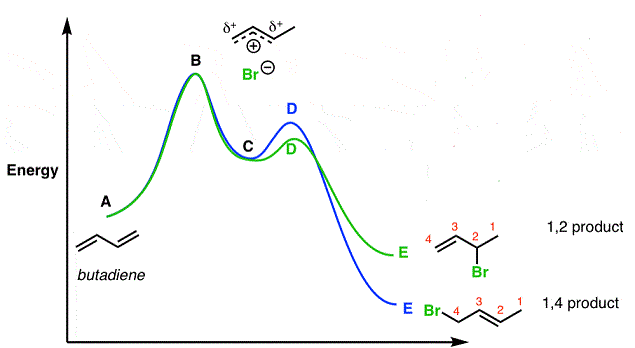
A basse temperature i reagenti hanno energia sufficiente a superare la barriera energetica del primo stadio della reazione e quindi si forma l’intermedio carbocationico.
Tuttavia non c’è abbastanza energia perché si verifichi la reazione inversa quindi a basse temperature le quantità relative dei prodotti ottenuti riflettono le barriere energetiche rispetto al secondo stadio della reazione. La barriera energetica di formazione del prodotto 1,2- è inferiore alla barriera energetica di formazione del prodotto 1,4- e il prodotto principale è quello di addizione 1,2-.
A temperature più alte vi è energia sufficiente per uno o più prodotti di ritornare all’intermedio e quindi le quantità relative dei due prodotti all’equilibrio dipendono dalle loro stabilità relative. Il prodotto termodinamico inverte meno facilmente perché deve superare una maggiore barriera energetica così diviene gradualmente predominante nella miscela del prodotto.
