Il polivinilcloruro noto come PVC è un polimero termoplastico tra i più versatili che trova largo uso nel settore delle costruzioni ad esempio in tubi, grondaie e pavimenti di vinile, nell’industria automobilistica, per i giocattoli, per gli imballaggi e nel campo medico: è infatti usato, tra l’altro, nei sistemi di drenaggio, nelle sacche di fluido, contenitori.
Proprietà del polivinilcloruro
Il PVC ha infatti eccellenti proprietà di isolamento elettrico e buona resistenza agli urti e alle sostanze chimiche. E’ intrinsecamente ignifugo, ma ad esso possono essere comunque aggiunti, in casi particolari, ritardanti di fiamma.
La versatilità del polivinilcloruro è dovuta al fatto che esso è compatibile con diversi tipi di additivi come i plastificanti che lo rendono flessibile; si distingue infatti il PVC-U ovvero quello non plastificato da quello plastificato che hanno caratteristiche e usi diversi.
Sintesi del vinilcloruro
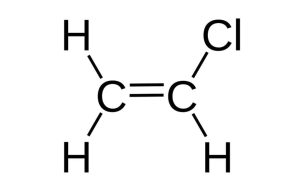
Il monomero di partenza è il cloroetene più noto come vinilcloruro (VCM) o cloruro di vinile avente formula C2H3Cl, alchene. L’etene o etilene viene ottenuto a livello industriale
dal cracking termico del gas naturale, dell’etano e di altri idrocarburi ad alto peso molecolare e dal suo isolamento dai gasi ottenuti nei processi di cracking e reforming nell’ambito dell’industria petrolchimica.
Il cloroetene è ottenuto in più stadi: nel primo stadio si ottiene l’1,2-dicloroetano.
Quest’ultimo può essere sintetizzato in due modi.
1) Per clorurazione dell’etene che avviene secondo la reazione:
CH2=CH2 + Cl2 → ClCH2CH2Cl
La reazione è esotermica ed ha una variazione di entalpia pari a ΔH = – 218 kJ/mol
2) Per ossiclorurazione dell’etene in presenza di acido cloridrico e ossigeno secondo la reazione:
CH2=CH2 +2 HCl +1/2 O2 → ClCH2CH2Cl + H2O
La reazione è esotermica ed ha una variazione di entalpia pari a ΔH = – 238 kJ/mol
Il vinilcloruro è quindi ottenuto dal l’1,2-dicloroetano tramite cracking termico in cui alla temperatura di 500°C e alla pressione di 15-30 atm l’1,2-dicloroetano si decompone in cloruro di vinile e HCl secondo la reazione:
ClCH2CH2Cl → CH2=CHCl + HCl
La reazione è endotermica ed ha una variazione di entalpia pari a ΔH = + 71 kJ/mol
Polimerizzazione
La polimerizzazione del cloruro di vinile avviene secondo un meccanismo radicalico che prevede una fase iniziale detta di iniziazione in cui si forma un radicale a partire, ad esempio, da un perossido per riscaldamento o in presenza di luce secondo la reazione:
R-O-O-R → 2 RO∙
Il radicale formatosi nella fase preliminare detta di iniziazione reagisce con il cloruro di vinile per dare un carbonio radicalico:
Il carbonio radicalico formatosi reagisce con un’altra molecola di cloruro di vinile per dare un altro radicale con maggior peso molecolare. Tale processo detto di propagazione si ripete n volte per dare una lunga catena polimerica.
Quando un radicale collide con un altro radicale sia esso RO∙ che un carbonio radicalico ha luogo la terminazione e si è formato il PVC che può essere rappresentato come:

La reazione di polimerizzazione è esotermica pertanto, per disperdere il calore prodotto dalla reazione, questa è condotta in soluzione, in emulsione o in sospensione; in modo che il mezzo liquido, evaporando, sottrae calore al sistema.
Al termine delle reazioni di polimerizzazione il polivinilcloruro si presenta come polvere o come granulato bianco che viene poi sottoposto alla tecnologia più opportuna sulla base delle caratteristiche e delle forme richieste.
Usi
Oltre a tutte le applicazioni in cui il polivinilcloruro è utilizzato non possono essere dimenticati i dischi in vinile che hanno accompagnato con le loro note i momenti migliori dei giovani degli anni ’60. Solo negli anni ’80 cedettero il passo alle musicassette a loro volta soppiantate negli anni ’90 dai CD.
La produzione di PVC ebbe inizio, in Italia, a Porto Marghera, agli inizi degli anni ’50 ma se da un lato ha portato indubbi benefici all’economia della nazione, dall’altro ha provocato un notevole impatto ambientale e soprattutto ha cagionato la morte a molti degli operai che avevano contatto con il VCM.
La letteratura scientifica già nel 1974 evidenziò che il VCM era responsabile dell’angiosarcoma nel fegato e successivamente fu dimostrata la sua cancerogenicità in altri organi quale cervello e polmone.
Attualmente sono pertanto adottate misure di sicurezza atte a scongiurare qualunque pericolo per i lavoratori e per l’ambiente.

