I perossiacidi anche detti acidi perossicarbossilici o peracidi sono composti organici caratterizzati dal gruppo funzionale –OOH e hanno formula generale R-CO-OOH dove R può essere un gruppo alchilico o un gruppo arilico. Alla categoria dei perossiacidi appartengono anche i perossiacidi inorganici tra cui l’acido di Caro dal nome del chimico tedesco H. Caro e l’acido perossifosforico.
I perossiacidi organici assumono il nome dell’acido carbossilico con lo stesso numero di atomi di carbonio anteponendo ad esso il prefisso per-.
Proprietà dei perossiacidi
Sono forti agenti ossidanti e vengono usati principalmente nell’ossidazione degli alcheni a epossidi (reazione di Prilezhaev), dei chetoni a esteri (reazione di Baeyer-Villiger ), delle ammine a ossidi di ammina e dei tioeteri a solfossidi. Questi acidi, una volta ritenuti poco pratici a causa del loro costo elevato e della scarsa selettività , vengono nuovamente considerati come un potenziale complemento agli agenti sbiancanti non contenenti cloro.
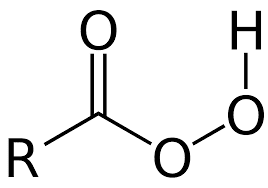
I perossiacidi sono molto più deboli rispetto agli acidi carbossilici con lo stesso numero di atomi di carbonio in quanto la forma deprotonata non è stabilizzata per risonanza come accade per gli acidi carbossilici. Ad esempio mentre il pKa dell’acido acetico vale 4.7 quello dell’acido peracetico vale 8.2.
I perossiacidi alifatici hanno odore sgradevole la cui intensità aumenta all’aumentare della lunghezza della catena e irritano la pelle, le mucose.
Sintesi
Si formano attraverso la reazione di equilibrio tra il perossido di idrogeno e un acido organico a catena corta. I peracidi sono stabili solo in determinate concentrazioni dei reagenti e la loro attività può essere variata mediante l’aggiunta di diversi rapporti di perossido di idrogeno e acido organico. I perossiacidi sono sintetizzati
a) per ossidazione dell’acidi carbossilici corrispondente con perossido di idrogeno secondo la reazione:
RCOOH + H2O2 ⇌ R-CO-OOH + H2O
b) dalla reazione di un alogenuro acilico con perossido di idrogeno secondo la reazione:
RCOCl + H2O2 ⇌ R-CO-OOH + HCl
Sono generalmente poco stabili; una eccezione è costituita dall’acido m-cloroperossibenzoico che viene usato abitualmente nelle reazioni di sintesi in laboratorio.
Reazioni
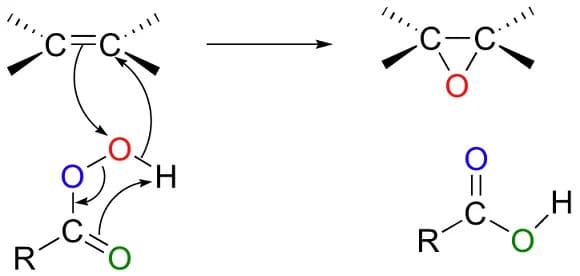
I perossiacidi reagiscono con gli alcheni per dare gli epossidi. La reazione è stereospecifica in cis e avviene in modo concertato; il secondo ossigeno del perossiacido che è parzialmente positivo agisce da elettrofilo mentre il doppio legame dell’alchene da nucleofilo
Essi reagiscono con i chetoni per dare gli esteri e con i chetoni ciclici per dare i lattoni secondo la reazione di ossidazione di Baeyer-Villiger
I perossiacidi reagiscono con le ammine terziarie per dare l’ossido di ammina; il secondo ossigeno del perossiacido che è parzialmente positivo agisce da elettrofilo mentre l’azoto agisce da nucleofilo con formazione di uno ione idrossiammonio e uno ione OH–. Quest’ultimo attacca l’idrogeno legato al gruppo idrossilico dell’azoto e si ottiene l’ossido di ammina


