Le regole di nomenclatura degli acidi carbossilici prevedono di individuare la catena più lunga contenente il gruppo carbossilico -COOH
Se la funzione –COOH rappresenta il gruppo a priorità maggiore della molecola, il nome dell’acido carbossilico si ottiene:
- dal nome dell’idrocarburo corrispondente alla più lunga catena di atomi di carbonio comprendente il carbossile
- sostituendo il suffisso –ano degli alcani, con –oico se l’acido è monocarbossilico, – dioico se è bicarbossilico
La posizione degli altri sostituenti presenti nella catena è indicata numerando la catena di atomi di carbonio del carbossile con il numero 1.
Se l’acido contiene un doppio legame si considera il nome dell’alchene, si elimina l’ultima lettera -e e si aggiunge il suffisso -oico; si indica il numero della posizione del doppio legame rispetto al carbonio carbossilico. Ad esempio si consideri il composto CH2=CHCH2COOH. Esso ha 4 atomi di carbonio quindi, poiché l’alchene con 4 atomi di carbonio si chiama butene il suo nome è acido butenoico. Poiché il doppio legame si trova sulla posizione 3 si chiama acido 3-butenoico
Oltre alla nomenclatura I.U.P.A.C. degli acidi carbossilici si può avere anche la nomenclatura comune molto diffusa per alcuni acidi. Esempi sono l’acido formico, acetico, butirrico, lattico e soprattutto gli acidi bicarbossilici come acido ossalico, malonico e succinico
Esercizi sulla nomenclatura degli acidi carbossilici
Attribuire il nome ai seguenti composti
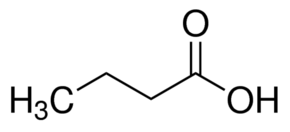
L’acido è costituito da 4 atomi di carbonio e pertanto si chiama acido butanoico sebbene il nome comune sia acido butirrico

Anche in questo caso l’acido è costituito da 4 atomi di carbonio ma presenta una ramificazione. Pertanto dando al carbonio carbossilico il numero 1 si ha che il gruppo metilico si trova in posizione 3. Il nome dell’acido è quindi acido 3-metilbutanoico sebbene il nome comune sia acido isovalerico

In questa formula vi sono 2 gruppi funzionali ovvero, oltre al gruppo -COOH vi è il gruppo carbonilico legato a un -CH3 e a -CH2. Pertanto è un gruppo chetonico. Poiché il gruppo carbossilico ha priorità maggiore rispetto a quello chetonico il composto si chiama acido 4-ossopentanoico sebbene il suo nome d’uso sia acido levulinico o acido γ-cheto valerico

In questo composto, costituito da 3 atomi di carbonio, vi è oltre al gruppo carbossilico anche il gruppo alcolico -OH. Poiché il gruppo carbossilico ha priorità maggiore rispetto a quello alcolico si chiama acido 2-idrossipropanoico sebbene sia noto come acido lattico

Questo composto ha 6 atomi di carbonio ma presenta, in posizione 5 rispetto al carbonio carbossilico, un doppio legame. Il suo nome è quindi acido 5-esenoico

Il composto presenta il gruppo amminico, che ha priorità minore rispetto al gruppo carbossilico, in posizione 3. Poiché l’acido presenta 4 atomi di carbonio si chiama acido 3-amminobutanoico

Il composto è un acido bicarbossilico costituito da 7 atomi di carbonio e si chiama acido eptandioico mentre il suo nome d’uso è acido pimelico
