I legami coniugati sono presenti una in molecola che ha due doppi legami e essi sono intervallati da un legame singolo. Il più semplice dei composti che presenta legami coniugati è l’1,3-butadiene
Il legame σ deriva dalla sovrapposizione di orbitali atomici con diverso carattere s e p e precisamente: s-sp3, s-sp2, s-sp, sp3– sp3, sp3– sp2, sp3-sp,sp2– sp2, sp2-sp, sp-sp.

Il legame π deriva, invece dalla sovrapposizione di orbitali atomici p-p. Sia gli elettroni del legame σ che quelli del legame π sono localizzati tra i nuclei che essi legano cosicché, per esempio, le molecole dell’etano e dell’etene sono rappresentate rispettivamente dalle due strutture.
Esistono, però, numerosi composti in cui uno o più orbitali di legame non sono localizzati tra due nuclei, ma sono disposti su una superficie più ampia: questi orbitali vengono detti delocalizzati.
Delocalizzazione e legami coniugati
Interessati a questa delocalizzazione sono in genere i legami π, in particolare quei legami π adiacenti (coniugati) ad atomi in cui sono presenti orbitali p. In questo modo, infatti, è possibile una sovrapposizione laterale. Le proprietà delle molecole in cui esistono orbitali molecolari delocalizzati sono piuttosto particolari e, in ogni caso, diverse da quelle che ci si aspetterebbero considerando i vari orbitali indipendenti l’uno dall’altro.
La controversia sulla struttura molecolare del benzene cominciò l’anno stesso della sua scoperta ad opera di Faraday nel 1825
Apparve chiaro, fin dall’inizio, che nel benzene dovessero essere presenti legami π a causa dei siti di insaturazione presenti nella molecola. Solo nel 1931 Hückel pubblicò uno studio basato sulla teoria degli orbitali molecolari il quale era in grado di giustificare le particolari caratteristiche del composto.
Ad esempio, il benzene, in cui sono presenti legami coniugati si presenta sotto due forme come si può vedere in figura:

esso viene detto ibrido di risonanza: la reale struttura della molecola non è data da nessuna delle due strutture prese singolarmente, ma dall’insieme delle due strutture che fanno parte dell’ibrido.
La freccia con la doppia punta che viene scritta tra una struttura limite e l’altra indica che le varie strutture sono in risonanza tra loro e ciascuna di esse contribuisce a rappresentare la molecola nel suo stato reale. Data una molecola in cui esista una coniugazione π-π o π-p, c’è la possibilità di rappresentarla attraverso la scrittura di un certo numero di formule limite che contribuiscono all’ibrido in misura diversa a seconda del loro contenuto energetico. Non tutte le strutture che possono essere scritte, infatti, danno lo stesso contributo all’ibrido. Per valutare il peso delle varie forme limite ci si attiene alle seguenti regole:
-
- Tutte le strutture devono avere lo stesso numero di elettroni accoppiati
- La posizione media dei nuclei deve rimanere inalterata in tutte le varie formule limite: in pratica una formula deve essere ottenuta dall’altra spostando solamente elettroni:
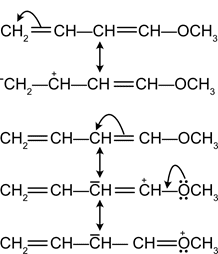
- Tutti gli atomi che prendono parte alla risonanza devono giacere in uno stesso piano in modo che sia massima la sovrapposizione degli orbitali p
- Il sistema è tanto più stabile (maggiore energia di risonanza) quanto maggiore è il numero di strutture energeticamente equivalenti.
- A questo proposito va ricordato che le strutture:
– con più legami covalenti sono più stabili delle strutture con un minor numero di legami covalenti
– in cui ci sia una separazione di carica sono meno stabili rispetto a quelle che non presentano separazione di carica
– in cui siano vicine cariche di segno uguale rivestono poca importanza
– dove la carica negativa sia localizzata sugli atomi più elettronegativi sono più stabili di strutture in cui la carica negativa sia localizzata sull’atomo meno elettronegativo
Le molecole in cui è possibile la delocalizzazione degli elettroni possono essere suddivise in tre gruppi.
Ovvero quelle in cui si ha coniugazione di tipo π- π; quelle in cui si ha coniugazione di tipo π -p e, infine quelle in cui si ha coniugazione π -σ
Tra gli esempi di legami coniugati π- π vi è l’1-3-butadiene; in particolare la delocalizzazione degli elettroni nell’1-3-butadiene e nei composti analoghi risulta particolarmente importante nella stabilizzazione degli intermedi di reazione, come quello derivato dalla somma di un protone:
CH2=CH-CH=CH2 + H+ → CH2– C+H -CH=CH2 ↔ CH3-CH=CH-C+H2
Per quanto attiene la coniugazione π -p il caso più comune è rappresentato da molecole che contengono un eteroatomo ibridato sp2. A titolo di esempio si può ricordare il cloruro di vinile:
CH2=CH-Cl in cui la nube elettronica π tra i due atomi di carbonio risente della presenza del doppietto elettronico non condiviso sul cloro e viceversa. Il cloruro di vinile può, infatti essere rappresentato dall’ibrido:
CH2=CH-Cl: ↔ :C–H2 -CH=Cl+
La coniugazione π -p può interessare anche un sistema costituito solamente da atomi di carbonio; in questo caso, non può trattarsi di un sistema allo stato fondamentale, ma di particelle estremamente reattive come carbanioni, carbocationi e radicali che risultano particolarmente stabilizzate da questo tipo di delocalizzazione:
CH2=CH-C–H2 ↔ C–H2-CH=CH2
Iperconiugazione
La coniugazione π -σ detta anche iperconiugazione, coinvolge la sovrapposizione degli elettroni π con gli elettroni σ di un atomo adiacenti. C’è da dire che il concetto di iperconiugazione è stato aspramente criticato: in effetti almeno nelle molecole neutre allo stato fondamentale, non sembra che l’iperconiugazione abbia molta importanza. Sembra, invece, che essa abbia un ruolo importante nello stabilizzare sistemi acidi come i carbocationi e anche i radicali:
H3C – C+H2 ↔ H2C =CH2 H+ ↔ …
