Gli isomeri sono sostanze chimiche che hanno diverse proprietà chimiche e fisiche pur presentando lo stesso numero di atomi nella molecola.
Ad esempio alla formula C2H6O corrispondono due sostanze diverse ovvero:
- l’etanolo CH3CH2OH
- il dimetiletere CH3OCH3
Queste due sostanze, pur avendo la stessa formula bruta mostrano diversa reattività. Inoltre l’etanolo ha una temperatura di ebollizione maggiore rispetto a quella del dimetiletere. Ciò è dovuto al fatto che l’etanolo forma legami a idrogeno.
Tipi di isomeri
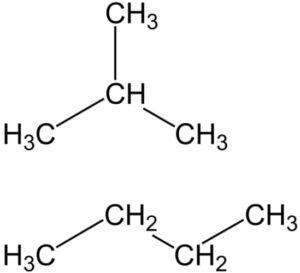
Un esempio è dato dal composto che ha formula brutaC4H10. Infatti a questa formula corrispondono due sostanze diverse ovvero:
- l’n-butano CH3CH2CH2CH3 ovvero una molecola lineare
- isobutano o 2-metilpropano CH3CH(CH3)CH3 che è una molecola ramificata
A differenza dei composti inorganici, in cui ad ogni formula grezza corrisponde una determinata formula di struttura, i composti organici presentano il fenomeno dell’isomeria. Si dicono isomeri due o più composti diversi aventi la stessa composizione elementare e quindi la stessa formula grezza, ma differente formula di struttura.
L’isomeria può assumere aspetti differenti a seconda che si riferisca alla :
– forma della catena carbonica che può essere lineare ramificata, ciclica
– posizione assunta da un dato sostituente o a un particolare tipo di legame nella catena carbonica
– disposizione spaziale degli atomi componenti (stereoisomeria). A sua volta si possono distinguere due tipi diversi di stereoisomeria :
- Isomeria ottica o enantiomeria. Gli enantiomeri o isomeri ottici sono molecole chirali che sono immagini speculari non sovrapponibili l’una dell’altra.

enantiomeri Gli enantiomeri , sebbene non sovrapponibili, come la mano destra e quella sinistra, hanno molte proprietà fisiche e chimiche identiche.
- Isomeria geometrica o cis – trans che si verifica quando nella molecola è impedita la libera rotazione nello spazio delle sottostrutture. Per esempio il 2 butene può presentarsi sotto le forme cis e trans: l’isomero cis ha due gruppi dalla stessa parte rispetto al doppio legame mentre l’isomero trans li ha da parti opposte.
