Gli epossidi sono composti costituiti da un anello a tre termini in cui uno dei vertici è costituito da ossigeno e sono pertanto degli eteri ciclici.
Sono un’importante classe di composti nella sintesi organica, poiché l’apertura dell’anello nucleofilo avviene facilmente secondo un meccanismo SN2 con inversione di configurazione nel centro del carbonio reagente.
Derivano dal metabolismo ossidativo di metaboliti endogeni come, ad esempio, intermedi nella biosintesi del colesterolo, nonché di composti xenobiotici attraverso processi di ossidazione chimica ed enzimatica.
Reattività degli epossidi
Contrariamente agli eteri che sono poco reattivi gli epossidi mostrano una particolare reattività dovuta alla tensione dell’anello. L’angolo di legame è infatti di circa 60° mentre gli orbitali dei due atomi di carbonio ibridati sp3 si direzionano secondo un angolo di 109.5°. La loro conformazione è quindi analoga a quella del ciclopropano
Gli epossidi pertanto possono dare anche in condizioni blande molte reazioni che portano, nella gran parte dei casi all’apertura dell’anello. La reazione avviene con nucleofili in condizioni acide in cui l’ossigeno epossidico viene protonato per primo, rendendolo un gruppo uscente migliore. Nella seconda fase, il nucleofilo tende ad attaccare il carbonio più sostituito, rompendo il legame CO più debole.
Sintesi
Il processo maggiormente diffuso per la sintesi dell’ossido di etilene che è insieme all’ossido di propilene uno degli epossidi maggiormente utilizzati è basato sull’ossidazione dell’etilene con aria e ossigeno in presenza di un catalizzatore a base di argento:

La reazione deve essere condotta ad una temperatura che deve essere compresa tra 260 e 290 °C per limitare la reazione di combustione:
CH2=CH2 + 3 O2 → 2 CO2 + 2 H2O
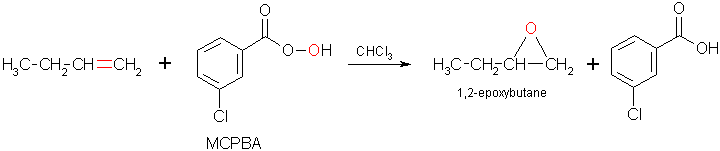
Tra i numerosi metodi per ottenere un epossido vi è la reazione tra un alcheni e un perossiacido con formazione dell’epossido e dell’acido carbossilico (reazione di Prilezhaev). Poiché la reazione avviene in modo concertato la stereochimica dell’alchene viene mantenuta nel prodotto di reazione. Quindi se si parte da un alchene in cui i gruppi alchilici sono in cis anche nell’epossido si troveranno in cis

Il perossiacido maggiormente utilizzato è l’acido 3-cloroperossibenzoico meglio noto come acido meta- cloroperossibenzoico (mCPBA)
Reazioni
Le reazioni di apertura dell’anello possono procedere sia tramite un meccanismo SN2 che SN1 a seconda dell’epossido e delle condizioni di reazione. Nel caso l’epossido è asimmetrico la struttura del prodotto dipende dal meccanismo con il quale avviene l’apertura dell’anello.
Quando un epossido asimmetrico viene trattato in una soluzione basica in presenza di metanolo l’apertura dell’anello avviene tramite un meccanismo SN2 e il sito di attacco del nucleofilo è il carbonio meno sostituito. In ambiente basico il metanolo si presenta prevalentemente sotto forma di un alcossido nucleofilo CH3O– che attacca il carbonio meno sostituito
Viceversa, se un epossido asimmetrico è trattato in una soluzione acida in presenza di metanolo l’apertura dell’anello avviene tramite un meccanismo SN1. Pertanto il sito di attacco del nucleofilo è il carbonio più sostituito. Il primo stadio prevede la protonazione dell’ossigeno mentre nel secondo stadio si rompe il legame carbonio-ossigeno. Si ha la formazione del carbocatione più stabile ovvero più sostituito che è attaccato dall’ossigeno del metanolo
L’epossidazione è largamente usata in chimica organica in quanto dagli epossidi si possono ottenere 1,2-dioli e un gran numero di composti 1,2-funzionalizzati. Gli epossidi vengono, tra l’altro, utilizzati per l’ottenimento di resine epossidiche.
L’epossidazione svolge un ruolo importante negli organismi animali nella biogenesi del colesterolo dopo che è avvenuta la formazione dell’unità di base isoprenica e la formazione dello squalene dalla condensazione di sei unità isopreniche si forma infatti lo squalene -epossido da cui si forma inizialmente il lanosterolo e successivamente il colesterolo.