La coniugazione è la diminuzione di energia di una molecola dovuta alla presenza di legami insaturi coniugati, cioè disposti in modo alternato a legami saturi. Le molecole in cui è possibile la delocalizzazione degli elettroni possono dare tre tipi di coniugazione:
- π-π
- π-p
- π-σ
Coniugazione di tipo π-π
Esempio di questo tipo di delocalizzazione è l’1,3-butadiene CH2=CH-CH=CH2. Tuttavia nei composti a catena lineare la risonanza ha un ruolo relativamente poco importante nel determinare la struttura elettronica dei vari sistemi allo stato fondamentale.
Il fatto che la lunghezza di legame C2-C3 nel l’1,3-butadiene sia più corta rispetto a quello di un analogo composto completamente saturo è da attribuire più all’ibridazione degli orbitali coinvolti nel legame che a un più o meno spiccato carattere di doppio legame. In realtà, il legame C2-C3 è essenzialmente un legame singolo derivato dalla sovrapposizione di due orbitali atomici sp2 più corto di un legame singolo derivato dalla sovrapposizione di due orbitali atomici sp3 a causa del maggior carattere s degli orbitali impegnati.
L’energia di risonanza ottenuta da misure di idrogenazione è infatti di sole 3.5 kcal/mol. La delocalizzazione degli elettroni nell’1,3-butadiene ha un ruolo importante nella stabilizzazione di intermedi di reazione come quello derivato dalla somma di uno ione H+:
CH2=CH-CH=CH2 + H+ → CH3-C+ H-CH=CH2 ↔ CH2=CH-C+ H-CH3
Il carbocatione risultante, infatti, viene notevolmente stabilizzato dalla risonanza da una coniugazione di tipo π-p.
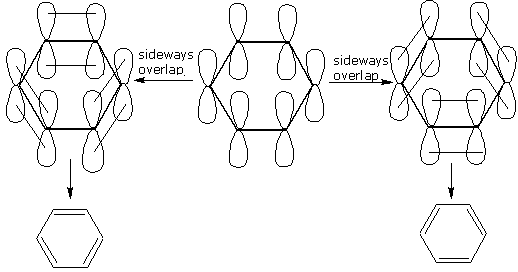
Benzene
L’esempio più classico di composto interessato a una coniugazione di tipo π-π è rappresentato dal benzene. Questa molecola ha sei atomi di carbonio ibridati sp2 uniti tra loro da legami σ (sp2-sp2) in modo da formare un ciclo a sei termini. I rimanenti orbitali pz sono perpendicolari al piano individuato dallo scheletro σ. Secondo il metodo del legame di valenza la molecola viene rappresentata da due strutture limite in risonanza tra loro:
In ognuna di queste strutture, gli orbitali pz si sovrappongono a due a due per dar luogo a tre doppi legami coniugati, ma localizzati tra due nuclei adiacenti. La molecola reale non è rappresentata né dall’una né dall’altra, ma dalle due strutture insieme. Essa ha un contenuto energetico inferiore a entrambe le strutture prese singolarmente.
L’energia di risonanza, cioè la differenza di energia tra la molecola reale e un ipotetico cicloesatriene in cui i doppi legami π non si influenzino reciprocamente, è, in questo caso di 36 kcal/mol.
Coniugazione π-p
Il caso più comune di molecole in cui è presente questo tipo di coniugazione è dato da molecole che contengono un eteroatomo legato a un carbonio ibridato sp2 come, ad esempio, il cloruro di vinile CH2=CH-Cl in cui la nube elettronica π tra i due atomi di carbonio risente della presenza del doppietto elettronico non condiviso sul cloro e viceversa.
Secondo la teoria degli orbitali molecolari si può ottenere una funzione d’onda che descrive l’intera struttura, ad eccezione dello scheletro σ dalla combinazione lineare degli orbitali atomici, cioè dalla combinazione lineare dei tre orbitali p (due del carbonio e uno del cloro)
Secondo il metodo del legame di valenza il cloruro di vinile è rappresentato dall’ibrido:
CH2=CH-Cl: ↔ :C–H2-CH=Cl+
La coniugazione π-p può interessare anche un sistema costituito solo da atomi di carbonio e, in questo caso, non si tratta di molecole allo stato fondamentale, ma di particelle estremamente reattive come carbanioni, carbocationi e radicali che risultano notevolmente stabilizzate da questo tipo di delocalizzazione come, ad esempio:
CH2=CH-C–H2 ↔ :C– H2-CH=CH2
Nel caso di carbanioni l’orbitale p è pieno, nel caso di carbocationi è vuoto mentre nel caso di radicali è pieno a metà.
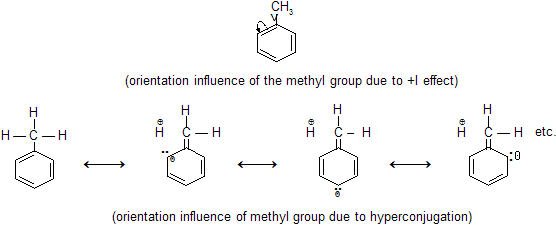
Coniugazione π-σ
Questo tipo di coniugazione detto iperconiugazione coinvolge la sovrapposizione degli elettroni π con gli elettroni σ di un atomo adiacente come accade, ad esempio, nel toluene:
Dato che si tratta di una risonanza la posizione media dei nuclei non cambia ovvero il protone non si stacca dal carbonio come avviene, ad esempio, nelle reazioni di eliminazione. La scrittura delle forme limite sta ad indicare la sovrapposizione parziale degli elettroni σ del legame C-H con gli elettroni π.