La chinolina il cui nome I.U.P.A.C. è 1-azanaftalene è un eterociclo aromatico avente formula C9H7N ed è un liquido incolore dall’odore penetrante che tende ad ingiallire e diventare scuro nel tempo.
La chinolina, che insieme all’isochinolina è isoelettronica con il naftalene.
Essa fu estratta per la prima volta nel 1834 dal chimico tedesco Friedlieb Ferdinand Runge dal catrame di carbone la cui struttura è quella di anello benzenico e un anello piridinico fusi.
Essa è una base debole e reagisce in modo analogo alla piridina e al benzene e dà reazioni sia di sostituzione elettrofila che nucleofila.
Derivati della chinolina si trovano in diversi composti naturali e hanno proprietà antimalariche, antibatteriche, antifungine, cardiotoniche, antinfiammatorie e analgesiche.
Sintesi della chinolina
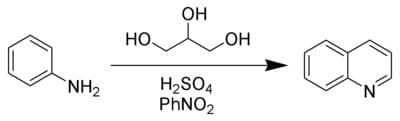
Può essere sintetizzata secondo la reazione di Skraup in cui l’anilina viene fatta reagire con acido solforico, glicerolo e un agente ossidante come il nitrobenzene
I derivati, come le 4-idrossichinoline sono ottenute con la sintesi di Conrad–Limpach dalla reazione dell’anilina con un β-chetoestere

Le chinoline sostituite sono ottenute con la:
1) sintesi di Combes in cui è fatta reagire l’anilina con β-dichetoni in cui avviene la chiusura dell’anello di una base di Schiff catalizzata da un acido

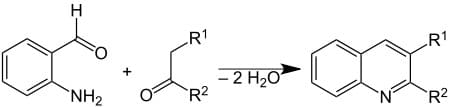
2) sintesi di Friedländer in cui la 2-amminobenzaldeide è fatta reagire con un chetone. Tale reazione è catalizzata da acido trifuoroacetico, acido toluensolfonico, iodio e una base di Lewis
3) reazione di Doebner–Miller in cui è fatta reagire l’anilina con un composto carbonilico α,β-insaturo in presenza di un acido di Lewis come il tetracloruro di stagno e un acido di Brønsted e Lowry, come l’acido p-toluensolfonico

Reazioni
Dà luogo a reazioni di sostituzione elettrofila sull’anello benzenico in posizione 8 e 5 piuttosto che sull’anello piridinico.
La nitrazione della chinolina dà luogo alla formazione di 5 e 8 nitrochinoline. I prodotti della solfonazione sono diversi a seconda della temperatura: a 220°C si forma in prevalenza l’acido 8-chinolinsolfonico mentre a 300°C si ha la sostituzione in posizione 6.

La sostituzione nucleofila che nella chinolina avviene più rapidamente che non nella piridina si verifica nell’anello piridinico abitualmente in posizione 2.

Può essere ridotta per idrogenazione catalitica con Nichel Raney con rottura dei doppi legami presenti nell’anello piridinico.
Può essere ossidata da permanganato di potassio con formazione dell’acido chinolinico. Esso è poco stabile dà luogo alla formazione di acido nicotinico.
Si riporta uno schema generale delle reazioni della chinolina
La chinolina e i suoi derivati trovano applicazioni nell’industria dei coloranti che sono utilizzati negli alimenti, nei cosmetici e nell’industria.
Inoltre è usata per la preparazione dell’idrossichinolina e della niacina e come solvente per resine e terpeni.


