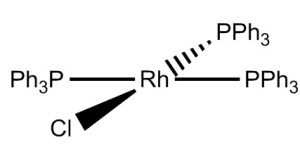
Il composto RhCl(PPh3)3 ovvero clorotris(trifenilfosfina) rodio (I) è noto come catalizzatore di Wilkinson che è usato nell’idrogenazione catalitica come catalizzatore omogeneo.
Struttura del catalizzatore di Wilkinson
Il catalizzatore di Wilkinson è un complesso a 16 elettroni avente struttura planare quadrata in cui il rodio ha numero di ossidazione +1.
Sintesi del catalizzatore di Wilkinson
 Viene ottenuto facendo reagire il tricloruro di rodio triidrato con trifenilfosfina in eccesso in presenza di etanolo secondo la reazione:
Viene ottenuto facendo reagire il tricloruro di rodio triidrato con trifenilfosfina in eccesso in presenza di etanolo secondo la reazione:
RhCl3 · 3 H2O + 4 PPh3 → RhCl(PPh3)3 + O=PPh3 + 2 HCl + 2 H2O
E’ un catalizzatore selettivo in quanto è in grado di idrogenare alcheni e alchini senza che siano coinvolti eventuali altri gruppi funzionali presenti nella molecola come C=O, CN, -NO2, -CO2R.
In realtà il catalizzatore di Wilkinson è un precatalizzatore che è convertito nella forma attiva dopo essere stato sciolto in un solvente come l’etanolo.
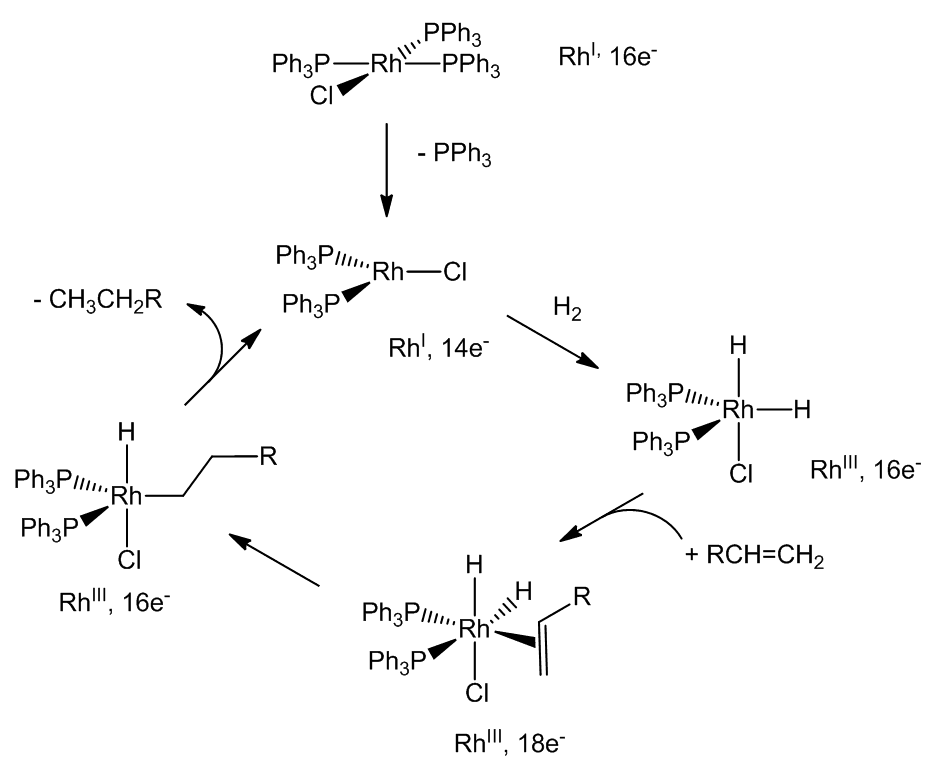
Meccanismo
Il catalizzatore, infatti, in tale solvente perde una delle molecole di fosfina che fungono da legante. Il sito rimasto vacante è rimpiazzato da una molecola di solvente con ottenimento di un complesso a 14 elettroni.
In atmosfera di idrogeno gassoso il complesso formato si somma, in una reazione di addizione ossidativa, a una molecola di H2 . Si ha la rottura del legame H-H e si forma un complesso del rodio pentacoordinato in cui il rodio ha numero di ossidazione +3.
Stante la variazione di numero di ossidazione si ha anche una variazione di colore dal rosso al giallo.
Il complesso [RhH2Cl(PPH3)2] ha 16 elettroni e può complessare l’alchene formando un complesso esacoordinato a 18 elettroni.
Successivamente si verifica un riarrangiamento intramolecolare dell’idruro con l’alchene coordinato e conseguente ottenimento di un complesso alchilico. Questo stadio è seguito rapidamente dal transfer di un altro idrogeno sul gruppo alchilico. Ciò genera un alcano che si allontana immediatamente dal catalizzatore in una eliminazione riduttiva.
Il rodio ritorna al numero di ossidazione +1 quindi il catalizzatore si trova rigenerato e il ciclo può così ricominciare.
Il meccanismo proposto è supportato dalle seguenti osservazioni:
1) la velocità della reazione diminuisce in presenza di un eccesso di PPh3 è ciò conferma la dissociazione iniziale di una molecola di legante PPh3
2) è osservato che composti π-acidi forti come l’etilene avvelenano il catalizzatore inibendo l’idrogenazione. Una molecola di tal genere, infatti, si sovrappone all’orbitale vuoto del metallo formando un legame coordinativo stabile grazie all’effetto di due contributi distinti ovvero donazione e retrodonazione. La donazione è dovuta alla sovrapposizione della densità elettronica dell’etilene con un orbitale accettore del metallo, mentre la retrodonazione è un effetto risultante dal flusso di densità elettronica degli orbitali pieni del metallo di tipo d sull’orbitale di antilegame π* presente sugli atomi di carbonio
La velocità di idrogenazione diminuisce all’aumentare dei sostituenti alchilici presenti a causa sia delle loro affinità di legame con il metallo centrale che per fattori sterici.