L’anilina è un composto organico aromatico avente formula C6H5NH2 e può essere considerata come un derivato dell’ammoniaca NH3 in cui un atomo di idrogeno è stato sostituito da un gruppo fenilico C6H5-. L’anilina fu isolata per la prima volta nel 1826 dal chimico tedesco Otto Unverdorben mediante distillazione distruttiva dell’indaco.
L’anilina è un liquido oleoso da incolore a marrone che si scurisce se esposto all’aria e alla luce.
Basicità dell’anilina
Il suo nome I.U.P.A.C. è fenilammina è quindi una arilammina ed ha un comportamento basico; reagisce infatti con gli acidi forti come ad esempio l’acido cloridrico per dare il cloruro di anilinio secondo la reazione:
C6H5NH2 + HCl → C6H5NH3Cl
che, come tutti i sali di anilinio, si decompone ad ammoniaca per riscaldamento.
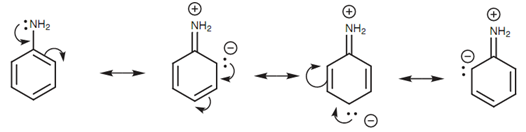
L’anilina è tuttavia meno basica delle ammine primarie in quanto il doppietto elettronico presente sull’azoto è parzialmente condiviso con l’anello aromatico per risonanza ed è pertanto meno disponibile ad essere un accettore di protoni e quindi comportarsi da base secondo Brønsted-Lowry.
Come la maggior parte delle ammine l’anilina ha un odore sgradevole di pesce marcio. A temperatura ambiente è un liquido incolore che tende ad ossidarsi in presenza di aria diventando scuro. E’ infiammabile e bruciando dà una fiamma fumosa caratteristica dei composti aromatici.
Sintesi
L’anilina fu preparata per la prima volta nel 1826 dall’indaco e successivamente dal catrame.
Attualmente, su scala industriale, viene preparata per idrogenazione del nitrobenzene a 200-300°C in presenza di catalizzatore:
C6H5NO2 + 3 H2 → C6H5NH2 + 2 H2O
Può essere ottenuta a basse temperature (- 40°C) facendo reagire il bromobenzene con l’ammoniuro di potassio secondo la reazione:
C6H5Br + KNH2 → C6H5NH2 + KBr
L’anilina reagisce reversibilmente con l’acqua per dare in una reazione di equilibrio l’idrossido di fenilammonio:
C6H5NH2 + H2O ⇄ C6H5NH3OH
Stante la minor basicità dell’anilina rispetto all’ammoniaca, una soluzione di anilina ha un pH più basso di una soluzione di ammoniaca con uguale concentrazione.
Reazioni dell’anilina
Reagisce con metalli come sodio, potassio e calcio, producendo idrogeno gassoso infiammabile
Tra le reazioni quella sicuramente più famosa è relativa alla sintesi dell’acetanilide (N-fenilacetammide) in cui l’anilina agendo da nucleofilo nei confronti dell’anidride acetica in presenza di acqua viene acetilata.
L’azoto con il suo doppietto elettronico attacca uno dei carboni carbonilici dell’anidride acetica a cui segue una deprotonazione:
successivamente lo ione acetato agisce da gruppo uscente con formazione dell’acetanilide:
Reagisce con acido nitroso alla temperatura di 0-5°C per dare un sale di diazonio. L’acido nitroso viene generato in situ dalla reazione:
NaNO2 + HCl → HNO2 + NaCl
I sali di diazonio contengono il gruppo azo – N=N- e costituiscono i precursori nella preparazione di coloranti azoici.
Il gruppo –NH2 presente nel composto è un gruppo attivante orto-para direttore e pertanto l’anilina dà molti tipi di reazione come, ad esempio, con il bromo per dare l’1,4,5-tribromoanilina.
La sostanza si decompone per forte riscaldamento a temperature superiori a 190°C, o per combustione producendo fumi tossici e corrosivi di ammoniaca, ossidi di azoto, monossido di carbonio e vapori infiammabili.
Usi
L’anilina è un intermedio versatile ed è quindi usata nelle sintesi industriali di numerosi composti. In particolare è usata per l’ottenimento di difenilmetano diisocianato da cui si ottengono i poliuretani e per la preparazioni di coloranti, di agenti vulcanizzanti nella preparazione della gomma, di prodotti fungicidi e di prodotti farmaceutici oltre che nella produzione di difenilammina e fenolo.