L’analisi qualitativa degli alcoli è fatta per per determinare se un alcol è primario, secondario o terziario. Queste analisi possono essere fatte secondo diverse procedure:
1) Saggio dell’acido cromico o ossidazione di Jones
2) Saggio di Ritter
3) Saggio di Lucas
Gli alcoli sono composti organici contenenti il gruppo funzionale –OH e possono essere classificati in primari, secondari e terziari a seconda che il gruppo –OH è legato a uno, due o tre gruppi alchilici:

Tale classificazione è importante a causa delle diversa reattività dei tre tipi di alcol.
Saggio dell’acido cromico o ossidazione di Jones
Il saggio dell’acido cromico è forse l’analisi qualitativa degli alcoli più diffusa.
L’acido cromico ossida un alcol primario a un’aldeide e successivamente a un acido carbossilico. Un alcol secondario, invece, è ossidato a chetone mentre un alcol terziario non reagisce in quanto nessun idrogeno può essere perso dal carbonio che è legato al gruppo –OH.
In una provetta mettere 2 mL di acetone e 3-4 gocce dell’alcol , aggiungere 2 gocce di acido cromico e agitare vigorosamente; a seconda dell’alcol avvengono le seguenti reazioni:
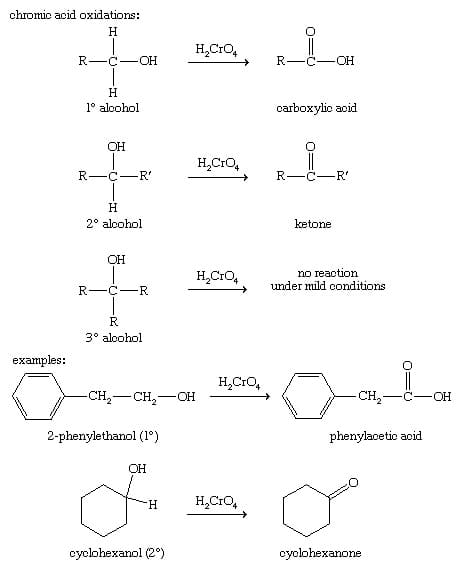
Quando avviene la reazione di ossidazione dell’alcol il cromo passa da numero di ossidazione + 6 a numero di ossidazione +3 e quindi la soluzione appare di colore verde.

Saggio di Ritter
È un’analisi qualitativa analoga a quello dell’acido cromico e fornisce lo stesso tipo di informazioni. Gli alcoli primari e secondari vengono ossidati dal permanganato di potassio ad acidi carbossilici e chetoni rispettivamente mentre gli alcoli terziari non danno alcuna reazione. Nel saggio di Ritter il manganese viene ridotto dallo stato di ossidazione +7 in cui si presenta di colore rosso-viola a stato di ossidazione + 4 in cui si presenta di colore bruno. Le reazioni coinvolte sono le seguenti:
RCH2OH + KMnO4 → RCOOH + MnO2
R2CHOH + KMnO4 → RCOR + MnO2
R3COH + KMnO4 → nessuna reazione e il colore della soluzione di permanganato non cambia.
In una provetta vengono messi 2 mL di acido acetico e 3-4 gocce dell’alcol e, dopo aver aggiunto il permanganato di potassio di agita vigorosamente. La comparsa di una colorazione bruna dovuta alla formazione di MnO2 è indice della presenza di un alcol primario o secondario. Si deve far attenzione ad aggiunger una minima quantità di permanganato di potassio in quanto se ne viene messo un eccesso la colorazione rosso-viola persiste anche in presenza di un alcol primario o secondario dando un falso negativo.
Saggio di Lucas
Tramite questo saggio è possibile individuare se un alcol è primario, secondario o terziario. Tale saggio può essere fatto solo se l’alcol è costituito al massimo da sei atomi di carbonio in quanto deve essere solubile nel reagente di Lucas affinché il test sia valido. Il reagente di Lucas è costituito da cloruro di zinco in acido cloridrico concentrato e il test si basa sulla velocità di formazione dell’alogenuro alchilico che si presenta insolubile.
La reazione di sostituzione avviene via SN1 e solo gli alcoli che possono dare un carbocatione stabile danno luogo alla reazione. Il catalizzatore acido attiva il gruppo –OH dell’alcol protonandolo con formazione di –OH2+ che fuoriesce con conseguente formazione del carbocatione. L’attacco dello ione Cl– che agisce da nucleofilo porta alla formazione dell’alogenuro alchilico secondo il meccanismo:

Gli alcoli terziari reagiscono immediatamente per dare una emulsione dell’alogenuro alchilico in acqua e la soluzione non appare pertanto limpida. La velocità della reazione è regolata dalla possibilità di formazione di un carbocatione terziario che è particolarmente stabile.
Gli alcoli secondari, che danno luogo alla formazione di un carbocatione secondario, meno stabile di quello terziario reagiscono in 5-10 minuti , mentre gli alcoli primari reagiscono abitualmente in più di un’ora in quanto si deve ottenere un carbocatione primario che è il meno stabile di tutti e pertanto spesso la soluzione viene riscaldata e agitata.
