Gli amminoacidi contengono sia gruppo carbossilico –COOH che il gruppo amminico –NH2 e sono anfoteri e la loro struttura dipende dal pH. Gli amminoacidi sono gli elementi costitutivi dei polipeptidi e delle proteine.
Equilibrio di dissociazione degli amminoacidi e pH
Si consideri l’equilibrio di dissociazione di un acido debole HA:
HA ⇄ H+ + A–
regolato dalla costante di equilibrio Ka. Si ricordi che quanto maggiore è Ka tanto più forte è l’acido ovvero quanto più è piccolo il valore di pKa ( – log Ka) tanto più forte è l’acido. L’espressione della costante di equilibrio è:
Ka = [H+][A–]/[HA]
Da tale espressione è possibile ottenere l’equazione di Henderson-Hasselbalch:
pKa = pH + log [HA]/[A–]
ovvero:
pH = pKa + log[A–]/[HA]
Da tale equazione si ha che se [A–] = [HA] ovvero la concentrazione dell’acido e della sua base coniugata sono uguali allora log [A–] / [HA] = log 1 = 0 e quindi pKa = pH.
Se il pH è abbassato rendendo la soluzione più acida allora pH < pKa e si ha che il valore del log [HA]/[A–] deve essere maggiore di zero quindi [HA] > [A–]: ciò implica che a in ambiente più acido prevale la forma protonata HA rispetto ad A–.
Se il pH è innalzato rendendo la soluzione più basica allora pH > pKa e si ha che il valore del log [HA]/[A–] deve essere minore di zero quindi [HA] < [A–]: ciò implica che in ambiente più basico prevale la forma deprotonata A– rispetto ad HA.
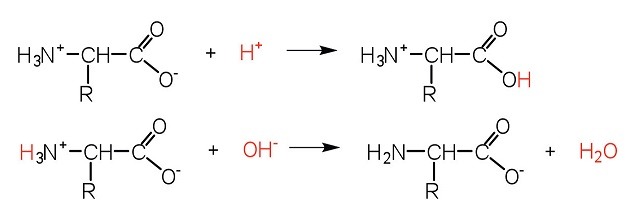
Gli acidi carbossilici RCOOH hanno un pKa di circa 5 mentre un sale di ammonio RNH3+ ha un pKa di circa 9 quindi il gruppo RCOOH è tra i due l’acido più forte in quanto il valore di pKa è più basso. L’amminoacido quindi si troverà in forma zwitterionica in cui la carica netta è zero dove l’acido ha protonato l’ammina in una soluzione a pH fisiologico.
Istidina
Per comprendere come la struttura dell’amminoacido sia influenzata dal pH e come la carica netta varia in funzione della sua variazione consideriamo ad esempio l’istidina.
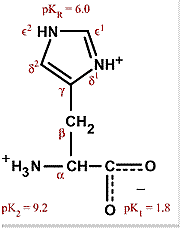
Questa è un α- amminoacido con un gruppo funzionale imidazolico che presenta tre gruppi acidi che hanno rispettivamente valori di pKa di 1.82 ( relativo al gruppo carbossilico), 6.04 ( relativo al gruppo imidazolico) e 9.17 (relativo al gruppo amminico). A seconda del pH l’istidina può presentarsi in quattro forme: a valori di pH minori di 1.82 si presenta in forma protonata con carica netta +2.
A pH maggiori e più precisamente per valori di pH compresi tra 1.82 e 6.04 il protone più acido ovvero quello appartenente al gruppo –COOH viene allontanato e quindi la carica netta è +1.
Se i valori di pH sono compresi tra 6.04 e 9.17 si deprotona l’azoto dell’anello imidazolico. Quindi la carica netta è 0 mentre a valori di pH maggiori di 9.17 e quindi la carica netta è -1.
In generale a pH = 7 gli amminoacidi hanno carica positiva e quindi si comportano in maniera analoga ai cationi. A pH maggiori essi hanno carica negativa e si comportano da anioni mentre ad un particolare valore di pH diverso da amminoacido a amminoacido detto pH del punto isoelettrico essi hanno carica netta uguale a zero e non si comportano né da cationi né da anioni.
Separazione
Una miscela di amminoacidi può essere pertanto separata per via elettroforetica. Questa tecnica si basa sula movimento di ioni sotto l’influenza di un campo elettrico. Una miscela di amminoacidi ad un determinato valore di pH, infatti, contiene:
- amminoacidi con carica netta positiva che migrano al polo negativo
- amminoacidi con carica netta negativa che migrano al polo positivo.
