Le ammine sono sintetizzate secondo numerosi metodi che possono essere riuniti in quattro grandi classi di reazioni:
1) reazioni di sostituzione nucleofila;
2) reazioni di addizione nucleofila;
4) reazioni di riarrangiamento
Reazioni di sostituzione nucleofila
– Dagli alogenuri alchilici
secondo lo schema generale:

L’ammina primaria così ottenuta può reagire ulteriormente con l’alogenuro alchilico dando un’ammina secondaria, terziaria e un sale di ammonio quaternario. Usando un eccesso di ammoniaca si ottengono migliori rese di ammina primaria. In ogni caso, però, si ottengono miscele di ammine primarie, secondarie, terziarie e sali di ammonio quaternari che rendono tale reazione poco utilizzabile.
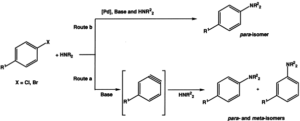
– Dagli alogenuri arilici.
Gli alogenuri arilici subiscono reazioni di sostituzione nucleofila con ammoniaca o ammine solo se contengono nella loro molecola gruppi elettronattrattori che stabilizzino l’intermedio carbanione
– Sintesi di Gabriel. L’idrogeno legato all’azoto delle immidi è dotato di notevole acidità a causa della stabilizzazione per risonanza dell’anione che ne risulta per deprotonazione.

Il sale potassico della ftalimmide, infatti, reagisce con gli alogenuri alchilici dando una N-alchilftalimmide da cui per idrolisi si ottiene l’ammina primaria esente da altri tipi di ammine
Reazioni di addizione
– Addizione ad alcheni.
Gli alcheni in condizioni drastiche (alte pressioni e catalizzatori costituiti da sali di cobalto) addizionano ammoniaca, ammine primarie, secondarie e terziarie
– Addizione nucleofila a epossidi.
L’addizione di ammoniaca ad ammine primarie e secondarie a substrati epossidici, provoca l’apertura dell’anello con formazione di β-ammino, β-(N-alchilammino), β-N,N-dialchilammino) etanoli:
NH3 +C2H4O → H2N-CH2-CH2-OH
RNH2 + C2H4O → RHN-CH2-CH2-OH
R2NH +C2H4O → R2N- CH2-CH2-OH
Reazioni di riduzione
– Riduzione di nitro- e nitrosocomposti:
R-NO2 → RNH2
Ar-NO2 → ArNH2
La riduzione viene effettuata soprattutto in ambiente acido con metalli quali zinco, stagno e ferro.
Il miglior metodo di riduzione dei nitrocomposti alifatici utilizza il litio alluminio idruro in etere anidro.
L’anilina viene sintetizzata su vasta scala per riduzione del nitrobenzene con ferro metallico in soluzione acquosa:
4 C6H5NO2 + 9 Fe + 4 H2O → 4 C6H5NH2 + 3 Fe3O4
Analoghe riduzioni ad ammine primarie vengono effettuate sui nitroso composti alifatici e aromatici
– Riduzioni di ossime,azocomposti, azidi, isocianati, N-ossidi
Le ossime per idrogenazione catalitica o per riduzione con amalgama di sodio e acidi o con sodio in etanolo, vengono ridotte ad ammine primarie
Gli azocomposti, per riduzione catalitica, danno ammine primarie attraverso la formazione intermedia di idrazocomposti:
C6H5-N=N-C6H5 (azobenzene) + H2 → C6H5-NH-NH-C6H5 (idrazobenzene)
C6H5-NH-NH-C6H5 + H2 → 2 C6H5-NH2
Le alchiazidi e gli isocianati sono generalmente ridotti ad ammine con litio alluminio idruro:
R-N3 ( alchilazide) → R-NH2
R-N=C=O (isocianato) → R-NH-CH3
Gli N-ossidi vengono ridotti ad ammine ad opera della trifenilfosfina (C6H5)3P:
R3N+O– → R3N + (C6H5)3P=O
– Riduzione di ammidi e nitrili. Le ammidi primarie, secondarie e terziarie sono facilmente ridotte alle corrispondenti ammine ad opera di litio alluminio idruro, diborano o con idrogenazione catalitica
Reazioni di riarrangiamento
Le reazioni di riarrangiamento dette anche reazioni di trasposizione. Tra esse si ha la trasposizione di:
Beckmann. In presenza di acidi minerali forti le chetossime riarrangiano a N-acilammine che per idrolisi danno ammine primarie e acidi carbossilici:

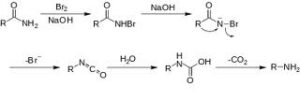
– Hofmann. Le ammidi sono degradate ad ammine primarie con un atomo di carbonio in meno rispetto all’ammide di partenza quando vengono trattate con bromo e cloro in soluzione alcalina:
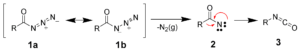
– Curtius. Le acilazidi per riscaldamento in ambiente acido o in ambiente basico traspongono a isocianati, dai quali per idrolisi si ottengono ammine primarie con un atomo di carbonio in meno