L’acido carminico è una sostanza colorante antrachinonica che trova in diverse specie di cocciniglie.
Tre esse Dactylopius coccus originarie del Sud America, Porphyrophora hamelii presente nell’Ararat e Porphyrophora polonica originaria dell’Europa centrale e di altre parti dell’Eurasia.
L’estrazione del colore carminio avviene dalle uova essiccate dell’insetto o per diretta essiccazione dell’insetto.

L’uso di insetti essiccati macinati per produrre pigmenti è noto fin dall’antichità. Un esempio è dato dal kermes ottenuto ottenuto dall’insetto femmina della Kermes vermilio che vive su una specie di quercia comune in Spagna, nel sud della Francia e dell’Italia, in molte isole greche e contiene l’acido chermesico.
Tuttavia all’inizio del 1500 quando gli spagnoli conquistarono l’impero azteco incontrarono i guerrieri aztechi che indossavano vestiti di un colore brillante più luminoso e vivido di qualsiasi tintura. Da allora spagnoli iniziarono a spedire gli insetti Dactylopius coccus gli insetti essiccati in Europa che furono utilizzati nei coloranti.
Struttura dell’acido carminico
L’acido carminico ha formula C22H20O13 costituito da acido 9,10-antrachinone-2-carbossilico legato a un gruppo metilico, un glucopiranosio e quattro ossidrili.
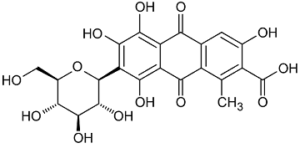
Il chimico britannico Henry Edward Schunk nel 1894 isolò l’acido carminico dalle cocciniglie. Il chimico tedesco Otto Dimroth ne riportò la struttura nel 1920. Questa formula, tuttavia, presentava un errore e solo nel 1965 i chimici indiani Bhatia e Venkataraman hanno corretto la posizione del gruppo carbossilico
Proprietà dell’acido carminico
Il colore può variare in funzione del modo di preparazione e appare come un solido marrone violaceo scuro, rosso vivo o rosso scuro che si scurisce a 12O°C e si decompone a 136°C
È solubile in etanolo, acido solforico concentrato, poco solubile in etere etilico; praticamente insolubile in etere di petrolio, benzene, cloroformio. In acqua ha una solubilità di 1.30 g/L.
Si presenta di colorazioni diverse a seconda del pH. Ad esempio quando il pH è pari a 4.8 è di colore giallo mentre a 6.2 è di colore viola.
L’acido carminico contiene cinque protoni che possono allontanarsi ovvero il protone del gruppo carbossilico in posizione 1 e i quattro protoni idrossilici nelle posizioni 2, 3, 4 e 5. In soluzioni acide valori di pH inferiori a 4.5, la molecola appare arancione, mentre a pH 7–7.7 rosso chiaro e rosso, e a pH superiore a 12, il suo colore è rosso magenta
Presenta quindi cinque valori di pKa rispettivamente pari a 3.39, 5.78, 8.35, 10.27, 11.5
È composto antrachinonico contenente una molecola di glucosio attaccata tramite un legame glicosidico. Gli anelli insaturi nella porzione antrachinonica assorbono fortemente la luce e sono responsabili del suo intenso colore viola
Reazioni
La reazione più importante dell’acido carminico è quella che dà luogo alla produzione del carminio, noto pigmento rosso

L’acido è trattato con una soluzione di ammoniaca o carbonato di sodio e la parte insolubile complessata con sali di alluminio e calcio. Il precipitato costituito da carminio è un precipitato intensamente rosso e stabile.
È un complesso costituito da due molecole di acido carminico che si comporta da legante bidentato legate a un atomo di alluminio
Usi
Il carminio è utilizzato per colorare i tessuti e come colorante alimentare, cosmetico e farmaceutico approvato dalla Food and Drug Administration degli Stati Uniti, sebbene alcune persone mostrino reazioni allergiche ad esso.
Il colore carminio è stabile in un ampio intervallo di pH tra 3.5 e 8 e ha un’eccellente stabilità al calore e alla luce. L’acido carminico viene quindi utilizzato come colorante batteriologico, ingrediente per vernici per artisti e pigmento per inchiostri. I principali usi alimentari del carminio includono carne lavorata, torte e pasticcini, yogurt e liquori.
