L’acido acetilsalicilico è una sostanza bianca, cristallina, debolmente acida, utilizzata in medicina per ridurre il dolore, la febbre o le infiammazioni. Il Chimico calabrese Raffaele Piria effettuò numerosi studi scientifici e nel 1838 scoprì l’ acido salicilico .
Successivamente Charles Frédéric Gerhardt sintetizzò l’acido acetilsalicilico in forma impura, ma solo il chimico Felix Hoffmann alla fine del 1800, presso l’allora piccola industria Bayer, sintetizzò l’acido acetilsalicilico per acetilazione dell’acido salicilico con acido acetico. Nel 1971 Vane scoprì il meccanismo attraverso il quale l’aspirina esercita le sue azioni antinfiammatorie, analgesiche e antipiretiche.
Circa 2000 anni prima il padre della medicina, Ippocrate, riscontrò le proprietà analgesiche della linfa estratta dalla corteccia di salice. Successivamente durante il periodo medioevale il decotto della corteccia di salice era dato a chi soffriva di dolori.
Da allora tale prodotto è stato uno dei farmaci più diffusi e, insieme agli antibiotici e cortisonici, costituisce il medicinale più venduto.
Oltre alla sua azione antidolorifica e antipiretica, piccole dosi di aspirina, commercializzata come Cardioaspirina, vengono somministrate per prevenire un’ostruzione arteriosa dovuta alla formazione di trombi e a seguito di un infarto.
Si è scoperto inoltre che tale sostanza, come gli altri farmaci antinfiammatori non steroidei (FANS) inibisce l’enzima cicloossigenasi coinvolto non solo nei meccanismi dell’infiammazione e del dolore, ma anche in quelli neoplastici, che porta alla formazione di prostaglandine (PG) che causano infiammazione, gonfiore, dolore e febbre.
Struttura
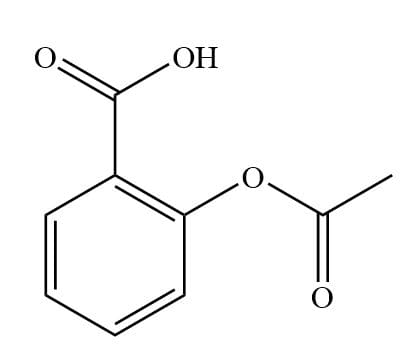
L’acido acetilsalicilico o (ASA) il cui nome I.U.P.A.C. è acido 2-(acetilossi)benzoico ha peso molecolare di 180.2 g/mol. Esso è un composto aromatico contenente sia il gruppo carbossilico –COOH che il gruppo estereo – COOR. Si presenta come un acido debole con una costante acida Ka pari a 3.2 · 10-4.
Ha una solubilità limitata in acqua, pari a 2–4 mg/mL e la sua solubilità varia significativamente con la temperatura. L’aspirina è più solubile in etanolo, etere etilico, cloroformio, soluzioni di idrossido di sodio e soluzioni di carbonato di sodio.
Sintesi dell’acido acetilsalicilico
Il composto che costituisce il precursore dell’acido acetilsalicilico è l’acido salicilico che può essere ottenuto dal fenolo. Quest’ultimo in ambiente basico dà il fenato che, in presenza di CO2 a caldo e sotto alte pressioni, dà luogo alla formazione del salicilato di sodio. La soluzione è acidificata con conseguente ottenimento dell’acido salicilico. Tale reazione è nota come reazione di Kolbe-Schmitt.

Per ottenere l’acido acetilsalicilico è fatto reagire l’acido salicilico con l’anidride acetica in presenza di acido fosforico quale catalizzatore
Il meccanismo prevede la protonazione di un ossigeno dell’anidride e, il carbonio carbonilico legato a tale ossigeno, subisce l’attacco dell’ossigeno alcolico dell’acido salicilico con formazione di un intermedio da cui attraverso alcuni passaggi si ottiene l’acido acetilsalicilico.
Dopo la sua preparazione è necessario isolare e, successivamente, purificare il prodotto. Sfruttandone la scarsa solubilità in acqua fredda la soluzione è raffreddata e poi si esegue la filtrazione.
Per allontanare l’eventuale acido salicilico e anidride acetica che non hanno reagito oltre che l’acido fosforico usato quale catalizzatore bisogna fare una purificazione.
L’anidride acetica si decompone in presenza di acqua in acido acetico secondo la reazione:
C4H6O3 + H2O → 2 C2H4O2
Inoltre sia l’acido acetico che l’acido fosforico sono solubili in acqua e possono essere allontanati lavando il precipitato con acqua. Solo l’acido salicilico che è scarsamente solubile in acqua non è allontanato e pertanto si deve procedere con una ricristallizzazione sfruttando la diversa solubilità dell’acido acetilsalicilico e dell’acido salicilico in etanolo. L’aspirina impura è sciolta in etanolo a caldo e la soluzione è fatta raffreddare lentamente: l’acido acetilsalicilico cristallizza e può essere separato per filtrazione mentre l’acido salicilico rimane in soluzione.
