Le strutture di Lewis sono usate per rappresentare gli elettroni di valenza di atomo o per rappresentare i legami covalenti presenti in una specie. Un atomo può essere rappresentato con simboli e puntini. Ad esempio
![]()
dove il simbolo rappresenta l’elemento e i puntini rappresentano gli elettroni del guscio più esterno.
Le strutture di Lewis sono usate per rappresentare i legami covalenti presenti in una molecola o in uno ione. Nella struttura di Lewis un atomo tende a condividere elettroni con altri atomi all’atto della formazione del legame in modo da contornarsi di otto elettroni.
La regola dell’ottetto, infatti, prevede che ogni atomo tende, attraverso la formazione di legami chimici ad acquistare o a perdere o a mettere in compartecipazione elettroni fino a raggiungere una configurazione elettronica esterna costituita da otto elettroni uguale a quella del gas nobile più vicino.
Per molecole semplici il modo più efficace per ottenere la struttura di Lewis consiste nello scrivere i diagrammi di Lewis per tutti gli atomi coinvolti nel legame e sommare il numero di elettroni di legame presenti. Ad esempio, l’ossigeno ha 6 elettroni nel guscio più esterno di cui due coppie solitarie e due elettroni spaiati quindi può essere rappresentato come:
La struttura di Lewis della molecola di acqua è quindi:
Ciascuno dei due elettroni spaiati dell’ossigeno forma un legame con l’elettrone dell’idrogeno e l’ossigeno risulta contornato da otto elettroni.
Esercizi sulle strutture di Lewis
1) Scrivere la struttura di Lewis per il metano CH4
Contiamo gli elettroni di valenza: essi sono otto in totale di cui 4 del carbonio e 1 per ogni atomo di idrogeno. Ciascun atomo di idrogeno risulterà legato quindi ad un elettrone spaiato del carbonio risultando la seguente struttura:
 in cui è rispettata la regola dell’ottetto.
in cui è rispettata la regola dell’ottetto.
2) Scrivere la struttura di Lewis per il biossido di carbonio CO2
Il carbonio, meno elettronegativo dell’ossigeno risulta essere l’atomo centrale. Contiamo gli elettroni di valenza: essi sono 16 di cui 4 del carbonio e 6 per ciascun atomo di ossigeno. Ciascun atomo di ossigeno ha due elettroni spaiati che si possono legare tramite un doppio legame all’atomo di carbonio centrale. I rimanenti due doppietti elettronici solitari di ciascun ossigeno si posizioneranno intorno ad esso e pertanto la struttura di Lewis risulterà:
Strutture di Lewis per ioni poliatomici
La struttura di Lewis per uno ione poliatomico può essere ottenuta in modo analogo a quello usato per le molecole semplici ma è necessario considerare il numero totale di elettroni per la carica dello ione poliatomico.
Se lo ione ha una carica negativa, il numero di elettroni che è uguale alla carica sullo ione deve essere aggiunto al numero totale di elettroni di valenza. Se lo ione ha una carica positiva, il numero di elettroni che è uguale alla carica deve essere sottratto dal numero totale di elettroni di valenza. Dopo aver scritto la struttura, l’intera struttura deve quindi essere posta fra parentesi con la carica all’esterno della stessa in alto a destra.
Esercizi
Scrivere le strutture di Lewis per:
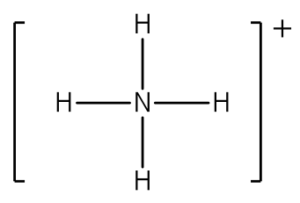
1) lo ione ammonio NH4+
Contiamo gli elettroni di valenza: essi sono 9 in totale di cui 5 dell’azoto e 4 (1 per ogni idrogeno). La carica dello ione +1 indica che si deve sottrarre un elettrone pertanto si devono computare 8 elettroni. Ciascun idrogeno si lega all’azoto e i quattro legami che si formano indicano che la regola dell’ottetto è rispettata e la struttura è completa.
Poiché vi sono solo due atomi iniziamo a posizionarli mettendo un legame tra i due. Contiamo gli elettroni di valenza: essi sono 7 in totale di cui 6 dell’ossigeno e uno dell’idrogeno. La carica negativa dello ione indica che si deve aggiungere un ulteriore elettrone: gli elettroni complessivi saranno quindi pari a 8.
L’ossigeno si lega all’idrogeno e pertanto vengono usati due elettroni; i rimanenti sei elettroni vengono sistemati intorno all’ossigeno (tre doppietti elettronici solitari). La regola dell’ottetto è rispettata e la struttura è completa.
Strutture di Lewis per specie stabilizzate per risonanza.
L’esistenza di molecole o ioni poliatomici stabilizzati per risonanza riguarda due o più strutture equivalenti. La risonanza può essere mostrata usando le strutture di Lewis per rappresentare le varie forme in cui la molecola o lo ione possono esistere. Dopo aver sistemato i doppietti elettronici solitari spesso risulta che gli atomi non siano contornati da otto elettroni. Pertanto gli atomi ( in specie carbonio, azoto e ossigeno) formano un doppio o un triplo legame usando uno dei doppietti elettronici solitari.
Esercizi
Scrivere le strutture di Lewis per:
1) lo ione nitrato NO3–
L’azoto è meno elettronegativo rispetto all’ossigeno e deve essere posto al centro.
Contiamo gli elettroni di valenza che risultano essere un totale di 23 di cui 5 dell’azoto e 6 per ogni ossigeno. La carica -1 indica che si deve aggiungere un ulteriore elettrone: gli elettroni complessivi saranno quindi pari a 24. Ogni ossigeno si lega all’azoto per un totale di sei elettroni.
Sistemiamo inizialmente i rimanenti 18 elettroni come 9 doppietti elettronici totali sui tre atomi di ossigeno (3 doppietti per ogni ossigeno). Sebbene siano rappresentati tutti i 24 elettroni nella struttura ( due per ognuno dei tre legami e 9 doppietti elettronici solitari intorno all’ossigeno, la regola dell’ottetto non viene soddisfatta per l’azoto.
E’ necessario quindi che vi sia un doppio legame tra uno degli atomi di ossigeno e l’azoto, ma poiché tutti e tre gli atomi di ossigeno possono formare il doppio legame vi saranno tre strutture di risonanza diverse che vengono affiancate mettendo una doppia freccia tra loro.
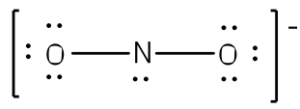
1) lo ione nitrito NO2–
L’azoto è meno elettronegativo rispetto all’ossigeno e deve essere posto al centro.
Contiamo gli elettroni di valenza che risultano essere un totale di 17 di cui 5 dell’azoto e 6 per ogni ossigeno. La carica -1 indica che si deve aggiungere un ulteriore elettrone: gli elettroni complessivi saranno quindi pari a 17. La carica -1 indica che si deve aggiungere un ulteriore elettrone: gli elettroni complessivi saranno quindi pari a 18. Ogni ossigeno si lega all’azoto usando due elettroni.
Si sistemano i rimanenti 16 elettroni inizialmente come 9 doppietti elettronici solitari di cui 3 per ogni ossigeno e 1 sull’azoto.
Sebbene tutti i 18 elettroni siano rappresentati nella struttura (2 per ciascuno dei due legami e 14 per i sette doppietti elettronici solitari) la regola dell’ottetto non viene rispettata per l’azoto pertanto quest’ultimo formerà un doppio legame con uno dei due ossigeni e vi saranno due strutture di risonanza di cui una è rappresentata in figura.
 Strutture di Lewis per specie elettron-sovrabbondanti
Strutture di Lewis per specie elettron-sovrabbondanti
Gli elementi aventi numero atomico maggiore di 13 formano spesso composti o ioni poliatomici in cui sono presenti elettroni in più. Per scrivere le strutture di Lewis di tali composti si procede, una volta che la regola dell’ottetto sia stata soddisfatta, assegnando gli elettroni extra all’atomo centrale come doppietti elettronici solitari o per aumentare il numero di legami. (si ricordi che per tali tipi di composti non sono presenti doppi legami).
Ad esempio si supponga di voler scrivere la struttura di Lewis per il pentafluoruro di fosforo PF5. Poiché l’elettronegatività del fluoro è maggiore rispetto a quella del fosforo quest’ultimo si posizionerà al centro della molecola.
Il numero totale di elettroni è 40 di cui 7 per ogni atomo di fluoro e 5 per il fosforo. Ponendo un legame semplice tra l’atomo di fosforo e ogni atomo di fluoro e sistemando gli elettroni rimanenti per soddisfare la regola dell’ottetto come doppietti elettronici solitari intorno a ciascun atomo di fluoro si giunge a 40 elettroni.
Strutture di Lewis per specie elettron-deficienti
Vi sono molecole o ioni poliatomici elettrondeficienti ovvero molecole in cui per un atomo non è soddisfatta la regola dell’ottetto. In tali casi agli atomi più elettronegativi sono assegnati gli elettroni sufficienti per rispettare la regola dell’ottetto e all’atomo meno elettronegativo rimane la deficienza di elettroni. Si supponga, ad esempio di scrivere la struttura di Lewis per il trifluoruro di boro BF3.
Poiché l’elettronegatività del boro è minore rispetto a quella del fluoro, il boro sarà nel centro della molecola. Il numero totale di elettroni è 24 di cui 7 per ogni atomo di fluoro e 3 del boro.
Ponendo un legame semplice tra il boro e ciascun atomo di fluoro e mettendo intorno al fluoro gli elettroni rimanenti come doppietti elettronici solitari tutti e 24 elettroni sono stati posizionati. Tuttavia per il boro non è rispettata la regola dell’ottetto e pertanto esso risulta elettron-deficiente.