La stabilizzazione per risonanza si verifica in molecole o ioni quando gli elettroni sono delocalizzati. Il chimico statunitense Linus Pauling nel 1928 introdusse per primo questo concetto. Quando una struttura di Lewis di una specie non descrive completamente il legame che si instaura tra atomi vicini la teoria del legame di valenza introduce delle strutture dette di risonanza.
Delocalizzazione degli elettroni
Ciascuna struttura non rappresenta completamente la specie che invece è un ibrido tra due o più strutture in cui gli elettroni sono delocalizzati.
Tale modello è confermato dalla reattività della specie, dalle lunghezze di legame e dalla sua particolare stabilità.
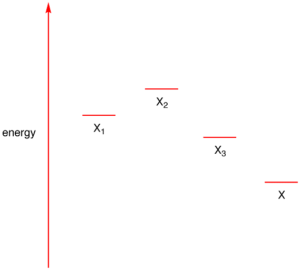
Una specie che gode della risonanza ha un’energia di risonanza ovvero di una stabilità extra rispetto alle singole strutture. L’energia di risonanza di una specie stabilizzata per risonanza è la differenza tra la sua energia e l’energia della sua forma di risonanza a energia più bassa.
Ad esempio un ipotetico ibrido X stabilizzato per risonanza costituito dalle tre forme limite X1, X2 e X3 ha energia minore rispetto a quella delle tre strutture limite.
La differenza tra X e X3 è l’energia di risonanza di X.
Reattività e risonanza
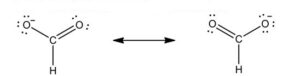
Essa influenza la reattività infatti, ad esempio, il benzene, in cui sono presenti tre doppi legame, non dà le tipiche reazioni di addizione dei composti insaturi come gli alcheni. Esso dà reazioni di sostituzione elettrofila aromatica in quanto la rottura di un doppio legame dovuta all’addizione comporta la perdita della risonanza.
Tra le varie implicazioni vi è l’acidità: ad esempio il metanolo CH3OH è molto meno acido dell’acido metanoico HCOOH.
Questa considerevole differenza di acidità è dovuta al fatto che nello ione metossido formato a seguito della dissociazione del metanolo secondo l’equilibrio:
CH3OH ⇄ CH3O– + H+
la carica negativa è localizzata sull’ossigeno.
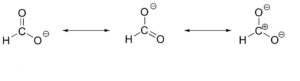
Nello ione metossido formato a seguito della dissociazione dell’acido metanoico secondo l’equilibrio:
HCOOH ⇄ HCOO– + H+
la carica negativa è delocalizzata e lo ione è stabilizzato
Spesso le diverse strutture limite di risonanza danno un contributo diverso alla struttura complessiva dell’ibrido e se una struttura ha energia minore ed è quindi più stabile di un’altra essa è più vicina alla rappresentazione reale.
Nel caso del metanoato, ad esempio mentre le prime due strutture sono equivalenti in termini di stabilità relativa la terza che presenta separazione di cariche con un carbonio carico positivamente e due ossigeni carichi negativamente ha un contributo trascurabile