Quando un fascio di luce solare è fatto passare attraverso un prisma ottico la luce bianca si scompone in uno spettro continuo formato da tante radiazioni colorate che vanno dal viola (λ = 400 nm) al rosso (λ = 750 nm) evidenziando sette colori principali con moltissime sfumature.
Lo spettro si dice continuo perché non si osserva presenza di alcuna zona d’ombra tra le diverse sfumature di colore.
Una sostanza solida portata all’incandescenza ( il comune filamento di una lampada) emette uno spettro continuo. Se la sostanza che emette la radiazione si trova invece allo stato gassoso essa produce uno spettro discontinuo. Se sono molecole ad emettere energia radiante si ottiene uno spettro discontinuo a bande.
Esso è costituito cioè da zone luminose piuttosto ampie intervallate da zone oscure. Se invece si tratta di atomi si ottiene uno spettro discontinuo a righe.
Spettro dell’idrogeno
Lo spettro atomico dell’idrogeno è il più semplice degli spettri a righe. Le righe Hα, Hβ, Hγ ecc. che appaiono nel visibile vennero studiate per la prima volta nello spettro del Sole e le loro lunghezze d’onda furono misurate con grande precisione.
 Nel 1885 Balmer rivelò che i risultati potevano essere espressi con la seguente relazione:
Nel 1885 Balmer rivelò che i risultati potevano essere espressi con la seguente relazione:
1/λ = ῡ = RH ( 1/22 – 1/n2) (1)
Dove RH è una costante e n un intero uguale a 3, 4, 5, 6 ecc. rispettivamente per le linee Hα, Hβ, Hγ, Hδ ecc. La costante RH è chiamata costante di Rydberg ed è uguale a 109677.76 cm-1 . Per gli spettri dell’idrogeno atomico, la frequenza delle righe può essere rappresentata dall’equazione generale:
ῡ = RH ( 1/n12 – 1/n22) (2)
in cui RH è la costante di Rydberg e n1 e n2 sono numeri interi, di cui il primo è costante da un estremo all’altro di ogni serie.
Si è visto che per la serie di Balmer n1 è uguale a due.
Nel 1908 Paschen trovò nella regione infrarosso dello spettro di idrogeno una serie di righe per cui n1 è uguale a tre. Nello spettro ultravioletto dell’idrogeno Lyman osservò alcune righe le cui frequenze erano riprodotte dalla (1) ponendo n1 = 1. Successivamente Brackett scoprì nell’infrarosso la serie per cui n1 = 4. Nella stessa regione dello spettro Pfund trovò la serie con n1 = 5.
Da tali risultati emerge che la frequenza di ogni riga dello spettro dell’idrogeno può essere espressa con la combinazione di due termini, ognuno dei quali è rappresentato da RH /n2 in cui n è un numero intero.
Teoria di Bohr
L’interpretazione di tale regolarità venne data per la prima volta dalla teoria di Bohr e più tardi dalla meccanica quantistica. Nel 1913 Bohr pubblicò tre saggi nei quali, accettando l’ipotesi per la quale l’elettrone ruota su orbite circolari intorno al nucleo, impose all’elettrone le seguenti condizioni di quantizzazione:
1° postulato: l’elettrone si muove intorno al nucleo su orbite circolari i cui raggi sono definiti dalla seguente condizione di quantizzazione: ( mv) 2 π r = n · h
Dove ( mv) è la quantità di moto, 2 π r la lunghezza della circonferenza, n un numero intero detto numero quantico (1, 2, 3…) e h la costante di Planck. Quando l’elettrone percorre una di queste orbite, dette stati stazionari, esso non emette né assorbe energia.
2° postulato: l’elettrone dell’atomo emette o assorbe energia solo quando “salta” da un’orbita a un’altra. In seguito all’assorbimento di energia l’elettrone è promosso da orbite interne ad orbite più periferiche e viceversa per emissione di energia.
Come conseguenza del 1° postulato si può dire che l’elettrone può trovarsi solo su orbite ben determinate il cui raggio è definito dal valore assunto dal numero quantico n. L’energia totale dell’elettrone, tenendo conto del raggio quantizzato delle orbite, diviene:
En = – 2 π2 mr e4/ n2h2 (3)
In cui mr, massa ridotta, è uguale a: memn/ me + mn dove me e mn sono rispettivamente la massa dell’elettrone e del nucleo; h la costante di Planck; e è la carica dell’elettrone e n il numero quantico principale che può assumere valori 1, 2, 3…
Ciascun valore di energia o livello energetico rappresenta uno stato stazionario in cui l’elettrone si muove attorno al nucleo con moto circolare uniforme percorrendo un’orbita circolare di raggio r. il più piccolo valore di E, livello energetico fondamentale, corrisponde a n = 1. Il valore n = ∞ rappresenta lo stato dell’atomo ionizzato. Nella (3) l’energia En appare come quantità negativa poiché, per convenzione, è scelto E∞ = 0 per lo ione.
Costante di Rydberg
La meccanica quantistica, attraverso l’equazione di Schrödinger è arrivata a proporre, per l’atomo di idrogeno la stessa relazione (3) precedentemente data da Bohr. L’emissione di energia è la conseguenza del passaggio da uno stato energetico stazionario a un altro con energia inferiore e la frequenza della radiazione emessa si calcola attraverso la relazione:
ΔE = En2 – En1 = hν = hῡc (4)
Dove En2 > En1. Sostituendo la (3) nella (4) si ha: ῡ = 2 π2 mr e4/ch3( 1/n12 – 1/n22) (5)
Confrontando la (5) con la (2) Bohr riuscì a ottenere l’espressione della costante di Rydberg:
RH = 2 π2 mr e4/ch3 (6)
Utilizzando la (6) si ricava per l’energia En = – RH/n2 (7)
Il valore minimo di energia per l’atomo di idrogeno è ricavato dalla (7) ponendo n=1 ed E1 = – RH e corrisponde al potenziale di ionizzazione dell’idrogeno. Infatti ponendo n1= 1 e n2= ∞ nella (5) si ottiene che la differenza di energia tra lo ione e lo stato fondamentale è RH. La minima quantità di energia assorbita dall’atomo nella transizione n1 = 1 → n2 = 2 è chiamata potenziale di eccitazione e corrisponde esattamente ai ¾ del potenziale di ionizzazione. Quanto detto per l’atomo di idrogeno può essere riassunto nella figura:
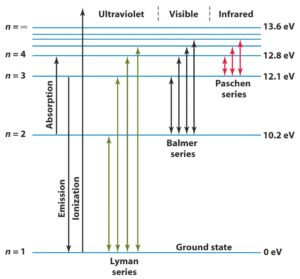 i valori di ΔE più elevati si registrano quando l’elettrone passa dalle orbite periferiche alla prima orbita stazionaria. Questi “salti” corrispondono alle energie delle righe dello spettro U.V. dette di Lyman. A valori di energia immediatamente più bassa troviamo i “salti” dell’elettrone dalle orbite periferiche alla seconda orbita stazionaria. Si hanno energie proprie delle righe dello spettro visibile dell’idrogeno (serie di Balmer). Lo stesso discorso si ripete per gli spettri I.R. (Paschen, Brackett) . Si può osservare che il salto di energia più basso di una serie è sempre maggiore dell’energia più elevata del salto più grande della serie successiva.
i valori di ΔE più elevati si registrano quando l’elettrone passa dalle orbite periferiche alla prima orbita stazionaria. Questi “salti” corrispondono alle energie delle righe dello spettro U.V. dette di Lyman. A valori di energia immediatamente più bassa troviamo i “salti” dell’elettrone dalle orbite periferiche alla seconda orbita stazionaria. Si hanno energie proprie delle righe dello spettro visibile dell’idrogeno (serie di Balmer). Lo stesso discorso si ripete per gli spettri I.R. (Paschen, Brackett) . Si può osservare che il salto di energia più basso di una serie è sempre maggiore dell’energia più elevata del salto più grande della serie successiva.
