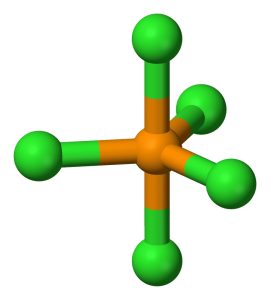
Il pentacloruro di fosforo è una sostanza inorganica avente formula PCl5 e geometria molecolare trigonale bipiramidale in cui il fosforo è ibridato sp3d.
Il fosforo ha numero atomico 15 e configurazione elettronica [Ne] 3s2, 3p3; a seguito della promozione di un elettrone nell’orbitale 3d ha 5 elettroni spaiati e forma 5 orbitali ibridi sp3d.
Questi cinque orbitali sono divisi in:
- Tre orbitali equatoriali diretti ai vertici di un triangolo equilatero planari e con angolo di 120°
- Due orbitali assiali perpendicolari al piano degli orbitali ibridi equatoriali che formano un angolo di 90° con gli orbitali ibridi equatoriali
La lunghezza di legame tra il fosforo e gli atomi di cloro disposti in posizione equatoriale è di 202 pm mentre la distanza di legame con gli atomi di cloro disposti in posizione assiale è di 240 pm.
Proprietà
Il pentacloruro di fosforo è un solido cristallino di colore giallo, dall’odore irritante e solubile in solfuro di carbonio, tetracloruro di carbonio e benzene.
È deliquescente e a contatto con l’aria umida tende a emanare fumi.
Sublima alla temperatura di circa 160 °C e a una temperatura maggiore i suoi vapori si dissociano in cloro e tricloruro di fosforo in una reazione di equilibrio.
Sintesi del pentacloruro di fosforo
Il pentacloruro di fosforo fu ottenuto per la prima volta dal chimico britannico Sir Humphry Davy nel 1808.
Può essere ottenuto:
- Dalla reazione di tricloruro di fosforo e cloro anidro secondo la reazione:
PCl3 + Cl2 → PCl5
- Dalla reazione tra fosforo bianco e cloro in presenza di solfuro di carbonio secondo la reazione:
P4 +10 Cl2 → 4 PCl5
Reazioni del pentacloruro di fosforo
- Idrolizza in presenza di aria umida per dare cloruro di fosforile e cloruro di idrogeno i cui fumi possono provocare il soffocamento secondo la reazione:
PCl5 + H2O → 2 HCl + POCl3
- In eccesso di acqua dà luogo a una reazione esotermica violenta con successiva esplosione per dare cloruro di idrogeno e acido fosforico secondo la reazione:
PCl5 + 4 H2O → 5 HCl + H3PO4
- In presenza di anidride solforosa dà luogo alla formazione di cloruro di tionile e cloruro di fosforile secondo la reazione:
PCl5 + SO2 → SOCl2 + POCl3
- In presenza di acido solfidrico dà luogo alla formazione di cloruro di tiofosforile e acido cloridrico secondo la reazione:
PCl5 + H2S → PSCl3 + HCl
- In presenza di anidride fosforica dà luogo alla formazione di cloruro di fosforile secondo la reazione:
3 PCl5 + P2O5 → 5 POCl3
- In presenza di arsenico dà luogo alla formazione di tricloruro di arsenico e tricloruro di fosforo secondo la reazione:
3 PCl5 + 2 As → 3 AsCl3 + 3 PCl3
- In presenza di acido ossalico dà luogo alla formazione di cloruro di fosforile, monossido di carbonio, biossido di carbonio e acido cloridrico secondo la reazione:
PCl5 + HOOCCOOH → POCl3+ CO + CO2 + 2 HCl
- In presenza di alcuni metalli finemente suddivisi dà luogo alla formazione dei cloruri corrispondenti:
Sn + 2 PCl5 → SnCl4 + 2 PCl3
2 Ag + PCl5 → 2 AgCl+ PCl3
Reagisce in presenza di composti organici contenenti il gruppo -OH:
- con gli acidi carbossilici dà luogo alla formazione del corrispondente cloruro di acetile, cloruro di fosforile e acido cloridrico secondo la reazione:
RCOOH + PCl5 → RCOOCl + POCl3 + HCl
- con gli alcoli dà luogo alla formazione del corrispondente cloruro alchilico, cloruro di fosforile e acido cloridrico secondo la reazione:
RCH2OH + PCl5 → RCH2Cl + POCl3 + HCl
Usi
Il pentacloruro di fosforo è usato:
- come agente clorurante e come catalizzatore per la produzione di prodotti chimici organici, intermedi e coloranti
- come catalizzatore nella produzione di acetilcellulosa utilizzata per le pellicole fotografiche e cinematografiche
- nell’industria farmaceutica per produzione di penicillina e cefalosporina.
- per produrre cloruri acidi e come catalizzatore per reazioni di ciclizzazione e condensazione
