Lo spettro dell’idrogeno è il più semplice degli spettri a righe poiché l’idrogeno è costituito solo dal nucleo contenente un protone intorno al quale si muove un elettrone. Gli elettroni possono muoversi in orbitali ad energia quantizzata .
L’orbitale 1s è quello più interno ( stato fondamentale ) a cui corrisponde il minimo di energia.
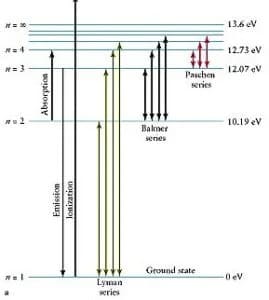
Affinché tale elettrone possa passare dall’orbitale 1 s ad un orbitale ad energia maggiore ( 2 s) è necessario somministrare energia che è pari a 10.19 eV.
L’energia che bisogna somministrare all’elettrone per consentirgli un passaggio ad orbitali ad energia crescente è via via maggiore fin quando non si giunge ad una energia ( energia di ionizzazione) per la quale l’elettrone si allontana dall’atomo.
Se, invece, l’elettrone che si trova in un orbitale ad alta energia passa ad un orbitale ad energia minore rilascia una certa quantità di energia sotto forma di radiazione avente una determinata lunghezza d’onda e dando origine ad una riga di emissione.
Le transizioni che gli elettroni compiono dagli orbitali periferici a quelli più interni si possono ordinare secondo valori decrescenti di energia: le variazioni di energia più elevate si registrano quando un elettrone passa da un’orbitale periferico a quello corrispondente allo stato fondamentale.
Righe spettrali nello spettro dell’idrogeno
L’insieme di tutti i salti che terminano nell’orbitale 1s dà luogo a una serie di righe spettrali che prendono il nome di serie di Lyman, le prime righe della quale vengono indicate con Lα, Lβ, Lγe corrispondono alle energie delle righe dell’ultravioletto. A valori di energia immediatamente più bassa si trovano i salti dell’elettrone dalle orbite periferiche alla seconda orbita stazionaria: si hanno energie proprie dello spettro del visibile e si ottengono righe della serie di Balmer dal nome del dal matematico svizzero Johann Jakob Balmer.
La prima riga è originata da un salto dall’orbita 3 all’orbita 2 e viene indicata con Hα, la seconda dalla 4 alla 2 e viene indicata con Hβ mentre la terza indicata con Hγ corrisponde al salto dall’orbita 5 alla 2. Lo stesso discorso si ripete per la serie di Paschen le cui righe corrispondono all’energia delle righe dell’I.R.
Le righe Hα, Hβ e Hγ che appaiono nel visibile vennero studiate per la prima volta nello spettro del Sole e le loro lunghezze d’onda furono studiate con grande precisione. Nel 1885 Balmer rivelò che i risultati potevano essere espressi con grande precisione tramite la relazione:
1/λ = ῡ = RH ( 1 / 22 – 1/ n2)
Dove RH è una costante e n è un numero intero uguale a 3, 4, 5, 6 ecc. Rispettivamente per le linee Hα, Hβ , Hγ, Hδ ecc. La costante RH è chiamata costante di Rydberg ed è uguale a 109677 cm-1 . La notevole precisione con cui tale formula riproduce le lunghezze d’onda della serie di Balmer è dimostrata dal confronto con i dati sperimentali. Dall’equazione si rileva che al crescere di n le righe si avvicinano tra loro. Le frequenze, inversamente proporzionali alla lunghezza d’onda, tendono progressivamente a un limite di convergenza che si può calcolare ponendo nell’equazione n uguale a infinito .
Esaminando l’equazione si nota che essa è formata da due termini: uno è costante o termine della serie mentre l’altro è variabile ed è detto termine corrente.
Principio di combinazione
Nel 1908 Ritz enunciò il suo principio di combinazione che è una generalizzazione della formula di Balmer. Tale principio afferma che il numero d’onda di una qualsiasi riga spettrale può essere rappresentato come la combinazione di due termini, uno dei quali è costante e l’altro variabile da un estremo all’altro della riga spettrale. Il principio di combinazione si applica in tutta la gamma degli studi spettroscopici e si è dimostrato di importanza fondamentale. Per gli spettri dell’idrogeno atomico la frequenza delle righe può essere rappresentata dall’equazione generale:
ῡ = RH ( 1/n12 – 1/n22)
in cui RH è la costante di Rydberg e n1 e n2 sono numeri interi, di cui il primo è costante da un estremo all’altro di ogni serie. Si è visto che per la serie di Balmer n1 è uguale a 2. Nel 1908 Paschen trovò nella regione infrarosso dello spettro dell’idrogeno una serie di righe per le quali n1 vale 3. Nello spettro ultravioletto dell’idrogeno Lyman osservò alcune righe le cui frequenze erano riprodotte dall’equazione di Balmer ponendo n1 = 1. Successivamente Brackett scoprì nell’infrarosso la serie per cui n1=4. Nella stessa regione dello spettro è stata trovata da Pfund la serie con n1= 5. Tali risultati possono essere racchiusi nella seguente tabella:
| Serie | n1 | n2 | Regione spettrale |
| Lyman | 1 | 2,3,4… | UV |
| Balmer | 2 | 3,4,5… | Visibile-UV |
| Paschen | 3 | 4,5,6… | IR |
| Brackett | 4 | 5,6,7… | IR |
| Pfund | 5 | 6,7,8… | IR |
Da tali risultati emerge il fatto che la frequenza di ogni riga dello spettro dell’idrogeno può essere espressa con la combinazione di due termini, ognuno dei quali è rappresentato da RH/n2 in cui n è un numero intero.
Energia
L’interpretazione di tale regolarità venne data per la prima volta dalla teoria di Bohr e, successivamente, dalla meccanica quantistica. Secondo Bohr l’atomo di idrogeno può assumere solo valori discreti di energia rappresentati dalla seguente equazione:
En = – 2π2mre4/ n2h2 (1)
In cui mr è la massa ridotta avente valore pari a
mr = memn/ (me+ mn)
dove me è la massa dell’elettrone, mn è la massa del nucleo; h è la costante di Planck, e è la carica dell’elettrone e n è il numero quantico principale che può assumere valori 1,2,3…
Ciascun valore di energia o livello energetico rappresenta uno stato stazionario in cui l’elettrone si muove intorno al nucleo con moto circolare uniforme percorrendo un’orbita circolare di raggio r.
Il più piccolo valore di E, livello energetico fondamentale, corrisponde a n=1. Il valore n= ∞ rappresenta lo stato dell’atomo ionizzato.
Nell’equazione En appare come quantità negativa poiché per convenzione, E∞ =0 per lo ione. L’emissione di energia è la conseguenza del passaggio da uno stato energetico stazionario a un altro con energia inferiore e la frequenza della radiazione emessa si calcola dalla relazione:
ΔE = En2 – En1 = hν = hῡc dove En2 > En1
Ovvero ῡ = ΔE/ hc
Sostituendo al valore ΔE quello ricavato nella (1) si ha:
ῡ = 2π2mre4/ch3 ( 1/ n22 – 1/n12)
confrontando la precedente relazione con l’equazione ῡ = RH ( 1/n12 – 1/n22) Bohr riuscì ad ottenere l’espressione della costante di Rydberg:
RH = 2π2mre4/ch3
utilizzando tale costante, si ricava per l’energia En l’espressione:
En= – RH/n2
Il valore minimo di energia per l’atomo di idrogeno è ricavato da quest’ultima espressione ponendo n=1 e E1 = – RH.
La quantità minima di energia assorbita dall’atomo nella transizione n1=1 → n2 = 2 è chiamata potenziale di eccitazione.
