Il potenziale di elettrodo è la forza elettromotrice di una cella galvanica costituita da un elettrodo di riferimento standard e da un altro elettrodo
Se si immerge una sbarretta di un metallo M in una soluzione contenente un suo sale solubile MXz , contenente quindi gli ioni Mz+ e X–, tra il metallo e la soluzione si stabilisce una differenza di potenziale.
La grandezza della d.d.p., che indichiamo con E, dipende dal metallo, dalla temperatura e dalla concentrazione (o meglio dall’attività) degli ioni Mz+ presenti in soluzione.
Alla temperatura di 25°C se gli ioni Mz+ hanno un’attività unitaria, la d.d.p. tra la sbarretta e la soluzione è detta potenziale di elettrodo del sistema Mz+(aq)/ M e si indica con il simbolo E°.
Si deve tenere conto che nel sistema considerato si ha un equilibrio del tipo:
Mz+(aq) + z e– ⇌ M(s)
La posizione dell’equilibrio di questa semireazione di riduzione, ovvero la tendenza che manifesta lo ione Mz+ a ridursi, è misurata da una costante K .
Energia libera
Tale costante è legata alla variazione di energia libera standard ΔG° secondo l’equazione:
ΔG° = – RT ln K (1)
In condizioni di attività unitaria (concentrazione 1.0 M) la semireazione di riduzione corrisponde al trasferimento di una mole di elettroni per litro di soluzione dalla soluzione al metallo, cioè al trasferimento della carica di z faraday ( 6.023 ∙ 1023 elettroni hanno la carica pari a 96487 coulomb) e pertanto ΔG° assumerà valore di:
ΔG° = – zE°F (2)
Uguagliando la (1) e la (2) si ha: – RT ln K = – zE°F
Da cui cambiando il segno e dividendo per RT si ha: ln K = zE°F/ RT
Ricordando che il logaritmo è un logaritmo naturale in base e si ha:
K = ezE°F/RT
Il valore del potenziale di riduzione della coppia Mz+/M fornisce pertanto una misura della tendenza a ridursi di Mz+ e di ossidarsi di M. Non è però possibile misurare direttamente il potenziale che si stabilisce tra la sbarretta metallica M (elettrodo) e la soluzione.
Elettrodo a idrogeno
Se ne può fare una misura indiretta con un apposito apparecchio: si abbia una soluzione contenente ioni Mz+ a concentrazione 1.0 M in cui sia immersa una sbarretta di del metallo M. Tra elettrodo e soluzione si stabilisce quella d.d.p. E° che si vuole determinare. Si consideri un altro recipiente che contenga ioni H+ ad attività unitaria. Nella soluzione sia immersa una sbarretta di platino e su tale materiale sia fatto gorgogliare idrogeno allo stato gassoso e alla pressione di 1 atm.
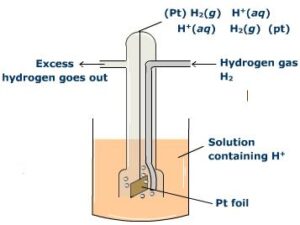 Tale sistema è detto elettrodo standard a idrogeno; tra elettrodo e soluzione si stabilirà una certa d.d.p. Le molecole di idrogeno sull’elettrodo di platino e gli ioni H+ presenti in soluzione danno luogo alla semireazione di equilibrio:
Tale sistema è detto elettrodo standard a idrogeno; tra elettrodo e soluzione si stabilirà una certa d.d.p. Le molecole di idrogeno sull’elettrodo di platino e gli ioni H+ presenti in soluzione danno luogo alla semireazione di equilibrio:
2 H+(aq) + 2 e– ⇌ H2(gas)
La costante di quest’ultima reazione dipende dal potenziale dell’elettrodo a idrogeno . Connettendo i due elettrodi a un potenziometro e collegando le due semicelle con un tubo di vetro a U rovesciato, detto ponte salino, contenente una soluzione salina come KCl, che serve a garantire l’elettroneutralità tra le due celle, detto E°M il potenziale di elettrodo della coppia Mz+(aq)/ M e E°H quello della coppia H+/H2 sul potenziometro si dovrà leggere un valore di potenziale pari a :
E = E°M – E°H
Si stabilisce per convenzione che il potenziale dell’elettrodo normale a idrogeno abbia valore zero. Con questo punto di riferimento il valore ΔE letto sul potenziometro fornisce, di conseguenza, il valore di E°M che è il potenziale normale di riduzione del metallo M in una soluzione di Mz+.
Con questo sistema è possibile determinare il potenziale normale di tutti i metalli.
