Una miscela eutettica è una miscela di sostanze il cui punto di fusione è minore rispetto a quello delle singole sostanze che la compongono
Lo studio degli equilibri tra le fasi di un sistema formato da due componenti viene normalmente condotto a pressione esterna costante e generalmente a quella atmosferica. I fattori che influenzano, quindi, gli equilibri di tali sistemi sono due e precisamente la temperatura e la composizione.
In conseguenza di ciò la regola delle fasi è applicata nella forma:
ν = c + 1 – f
dato che si ammette che possa variare una sola variabile fisica cioè la temperatura. Gli equilibri fra sistemi condensati trovano una importante applicazione nello studio della costituzione delle leghe metalliche. Ciò è fatto prendendo in considerazione solo gli equilibri tra le fasi condensate (solido-liquido) esistenti in tali sistemi. Non si tiene conto della fase di vapore quando ad essi è applicata la regola delle fasi.
Se prendiamo in considerazione una soluzione liquida formata da due componenti A e B e la raffreddiamo a pressione esterna costante, ad una certa temperatura cristallini di A cominciano a separarsi dalla soluzione.
Sistema monovariante
A questo punto il sistema, in accordo con la regola delle fasi espressa dalla precedente equazione, diventa monovariante. Infatti i componenti sono due e così pure le fasi (una solida e una liquida).
Ciò implica che, a pressione costante, e una volta fissata la composizione della miscela, esiste una sola temperatura alla quale essa è in equilibrio con i cristallini di A.
Poiché in seguito alla separazione di cristallini di solvente, la composizione della soluzione è diversa da quella originale dato che è diventata più concentrata, essa lascia separare altri cristallini di A ad una temperatura inferiore a quella precedente: infatti, l’abbassamento crioscopico di una soluzione è proporzionale alla concentrazione molale del soluto. Pertanto, continuando a sottrarre calore alla soluzione, il processo di cristallizzazione di A prosegue a temperature sempre più basse fino a quando la soluzione diventa satura ovvero presenta corpo di fondo (curva TAE della figura).
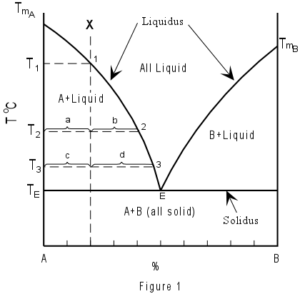 A questo punto, cui corrisponde la temperatura TE il solvente A e il soluto B cristallizzano e la temperatura TE rimane costante fino a che il sistema diviene zerovariante costituito cioè da due componenti e da tre fasi (una liquida formata dalla soluzione e due solide formate rispettivamente dai cristallini di A e dai cristallini di B). Pertanto, continuando a sottrarre calore al sistema, la temperatura rimane costante sul valore TE fino a quando tutta la miscela passa allo stato solido.
A questo punto, cui corrisponde la temperatura TE il solvente A e il soluto B cristallizzano e la temperatura TE rimane costante fino a che il sistema diviene zerovariante costituito cioè da due componenti e da tre fasi (una liquida formata dalla soluzione e due solide formate rispettivamente dai cristallini di A e dai cristallini di B). Pertanto, continuando a sottrarre calore al sistema, la temperatura rimane costante sul valore TE fino a quando tutta la miscela passa allo stato solido.
Punto eutettico
La miscela liquida di composizione XE dei due componenti A e B che solidifica a temperatura costante è detta miscela eutettica e la corrispondente temperatura TE è detta temperatura eutettica o punto eutettico. Sottraendo calore a una miscela liquida la cui composizione iniziale è molto ricca del componente B questa lascia via via separare cristallini di B. La sua composizione varia secondo la curva TBE fino a quando diventa uguale a quella eutettica XE.
A questo punto si separano contemporaneamente cristallini di A e cristallini di B. La temperatura rimane costante sul valore TE fino a quando tutta la soluzione passa allo stato solido.
Raffreddando una miscela la cui composizione iniziale coincide con quella eutettica XE essa solidifica tutta insieme alla temperatura TE . Si comporta praticamente come un composto puro. Esiste, tuttavia, una differenza di fondo tra eutettico e composto puro. Un composto puro, infatti, è un sistema chimico omogeneo in ogni sua parte.
Una miscela eutettica è un sistema chimico eterogeneo. Allo stato solido, infatti, è possibile distinguere, ad esempio con un microscopio, sia i cristalli di un componente che i cristalli dell’altro.
Grafico
Nella figura in cui TA e TB sono i punti di solidificazione rispettivamente di A puro e di B puro. Si distinguono in particolare:
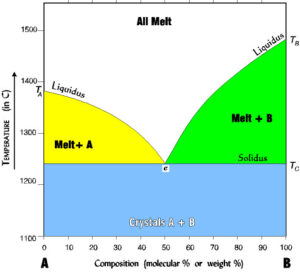
- Il campo di stabilità delle diverse miscele liquide che è situato al di sopra della curva TA e TB. In ogni punto di questa regione il sistema è bivariante. Cioè, a pressione costante, possono essere variate sia la composizione della soluzione che della temperatura. In questo caso non si altera l’equilibrio esistente, ovvero, senza provocare la comparsa di un’altra fase
- Il campo di stabilità delle diverse miscele solide formate dai cristallini di A e dai cristallini di B, il quale è situato nella regione al di sotto della linea orizzontale tracciata a partire dalla temperatura eutettica. In ogni punto di questa regione il sistema è monovariante quindi, variando la temperatura entro ragionevoli limiti, non è alterato l’equilibrio esistente (comparsa o scomparsa di fasi)
- Il campo di stabilità delle due zone: soluzione + solido A e soluzione + solido B, comprese tra la curva TAETB e la linea orizzontale tracciata a partire dalla temperatura eutettica. In ogni punto di queste regioni il sistema è monovariante. Infatti si hanno due componenti e due fasi e precisamente quella liquida e quella del solido A, oppure quella liquida e quella del solido B. Quindi, una volta fissata la temperatura, risulta definita la composizione di equilibrio della fase liquida. La composizione della fase solida non può essere alterata in quanto essa è costituita da un solido puro ( il solido A o il solido B).
Per ricavare la composizione della soluzione in equilibrio con la fase solida corrispondente a un punto interno alle due zone determinato ad una certa temperatura si traccia una linea orizzontale fino ad incontrare la curva. La proiezione sull’asse delle ascisse fornisce la composizione all’equilibrio della soluzione a quella determinata temperatura.
