I fluidi supercritici indicati con l’acronimo SCF sono sostanze che si trovano a una temperatura e a una pressione superiore a quella critica le cui proprietà sono in parte simili a quelle di un liquido e in parte simili a quelle di un gas.
Questo particolare comportamento delle sostanze fu osservato per la prima volta nel 1822 dall’ingegnere francese Charles Cagniard de La Tour. Lo scienziato fece un famoso esperimento con la canna del cannone. Il chimico irlandese Thomas Andrews coniò la locuzione fluido supercritico.
Fluidi supercritici e impatto ambientale
È importante sviluppare tecnologie alternative con un impatto ambientale minimo per prodotti con proprietà speciali progettate su misura. Ridotto consumo di energia, meno residui tossici, conversione efficiente dei reagenti in prodotti, meno sottoprodotti e maggiore qualità e sicurezza dei prodotti finali sono requisiti fondamentali per i processi futuri.
Le tecnologie ad alta pressione sono uno strumento relativamente nuovo per soddisfare queste esigenze. Le tecnologie che utilizzano l’alta pressione hanno sviluppato diversi processi che hanno portato a prodotti completamente nuovi con caratteristiche speciali
Tra i diversi processi ad alta pressione, i fluidi subcritici e supercritici (SCF) offrono lo sviluppo di diverse eccellenti tecnologie di lavorazione grazie alle loro proprietà fisico-chimiche.
I fluidi supercritici si possono trovare anche in natura infatti l’acqua supercritica si trova vicino all’eruzione dei vulcani sottomarini. Gli SCF hanno viscosità e diffusività simili a quelle del gas, densità e costante dielettrica simili a quelle dei liquidi e proprietà di solvatazione che possono essere controllate dalla pressione e/o dalla temperatura. Queste proprietà li rendono ottimi solventi per varie applicazioni.
Acqua
Mettendo un campione di acqua in un contenitore chiuso a 25°C, dopo aver sottratto l’aria è presente una miscela di acqua e vapore alla pressione di 0.03 atm. Si può osservare un confine tra la fase liquida più densa e quella di vapore meno densa.
All’aumentare della temperatura la pressione del vapore acqueo aumenta come si può vedere dal diagramma di fase dell’acqua.

Alla temperatura di 374°C la pressione è pari a 218 atm un ulteriore aumento della temperatura provoca la scomparsa del confine tra fase liquida e fase vapore. Tutta l’acqua è presente in un’unica fase la cui proprietà sono intermedie tra quelle dello stato liquido e gassoso.
Analogamente ai gas i fluidi supercritici tendono ad espandersi ma la loro densità è maggiore a quella dei gas e si avvicina di più a quella del liquido.
In analogia con il comportamento dei liquidi il fluido supercritico è in grado di agire da solvente. In questo stato, tuttavia, le molecole di acqua non presentano legami a idrogeno e sono quindi libere di muoversi ed esercitare il loro potere solvente in misura maggiore. L’acqua supercritica ha una bassa costante dielettrica vicina a quella dei composti organici. Le reazioni organiche in acqua supercritica, quindi, diventano più omogenee, determinando una velocità di reazione più elevata.
Anidride carbonica
L’anidride carbonica è tra i fluidi supercritici più utilizzato a causa del suo basso costo, inerzia chimica, assenza di tossicità e di infiammabilità.
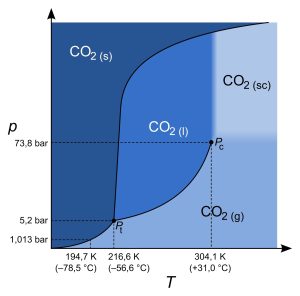
L’anidride carbonica è disponibile ad elevato grado di purezza. Inoltre il punto critico corrispondente alla temperatura di 31°C e alla pressione di 73 atm è facilmente raggiungibile. Inoltre dopo l’uso può essere facilmente recuperata.
L’anidride carbonica supercritica è diventata un solvente molto comune nell’industria alimentare. È utilizzata per decaffeinare il caffè, rimuovere i grassi dalle patatine ed estrarre composti aromatici dagli oli di agrumi e può essere descritta come un solvente green. L’anidride carbonica supercritica è uno dei solventi facilmente riciclabili più attraenti, consentendo la progettazione di processi sicuri per l’ambiente. La CO2 supercritica ha proprietà simili a quelle dei solventi fluoroorganici
