L’ uso delle titolazioni conduttimetriche per la determinazione del punto finale di una titolazione volumetrica è particolarmente diffuso nel caso di titolazioni acido-base in cui è sfruttata la differenza dei valori di mobilità ionica di H+ e OH– rispetto agli altri ioni.
Tabella
Si riportano i valori di conducibilità ionica equivalente di alcuni ioni a 25°C in cm2Ω-1
| Cationi | Λ | Anioni | Λ |
| H3O+ | 349.8 | OH– | 198.5 |
| K+ | 73.5 | Br– | 78.4 |
| NH4+ | 73.4 | I– | 76.8 |
| Ba2+ | 63.6 | Cl– | 76.3 |
| Ag+ | 61.9 | NO3– | 71.4 |
| Na+ | 50.1 | ClO4– | 67.3 |
| Li+ | 38.7 | CH3COO– | 40.9 |
Nelle titolazioni conduttimetriche si segue la variazione di conducibilità della soluzione con il procedere della titolazione stessa. Le reazioni di neutralizzazione consistono in un’associazione di ioni secondo l’equazione:
H3O+ + OH– → 2 H2O
Prima del punto equivalente si ha una considerevole diminuzione della conduttanza dovuta alla scomparsa dalla soluzione della specie titolata (H3O+ oppure OH– ) in base alla reazione di neutralizzazione. Dopo il punto equivalente la conduttanza aumenta notevolmente dal momento che gli ioni titolanti aggiunti (H3O+ oppure OH–) rimangono liberi in soluzione. Al punto equivalente, pertanto, la conduttanza assumerà un valore minimo facilmente rilevabile. La variazione della conduttanza con il procedere della titolazione dipende anche dalla forza degli elettroliti reagenti. Analizziamo pertanto due singoli casi che costituiscono un riferimento per altre titolazioni:
Acido forte- base forte
Supponiamo di titolare una soluzione di HCl con NaOH. Inizialmente sono presenti in soluzione ioni H3O+ e Cl–. L’elevata conduttanza iniziale della soluzione dipende dalla loro elevata mobilità. Con il procedere della titolazione, l’aggiunta di ioni Na+ e OH– provoca una variazione nel contenuto ionico della soluzione.
 Nel corso della titolazione prima del punto equivalente si verifica per gli ioni:
Nel corso della titolazione prima del punto equivalente si verifica per gli ioni:
H3O+ : la loro concentrazione diminuisce progressivamente
Cl– : la loro concentrazione rimane costante
Na+ : la loro concentrazione aumenta progressivamente
OH–: la loro concentrazione rimane trascurabile (< 10-7 )
In questa fase della titolazione si ha una graduale sostituzione di ioni H3O+ con ioni Na+. Essendo questi ultimi molto meno conduttori degli ioni H3O+ (vedi tabella) si prevede una diminuzione regolare della conduttanza per ogni incremento di titolante aggiunto. Dopo il punto equivalente si ha che gli:
H3O+ : sono in concentrazione trascurabile (< 10-7 )
Cl– : la loro concentrazione rimane costante
Na+ : la loro concentrazione aumenta progressivamente
OH–: aumentano regolarmente
La presenza in soluzione di ioni OH– ad alta conduttività ed in continuo aumento, comporta un incremento della conduttanza rilevabile ad ogni aliquota di titolante aggiunto. In queste titolazioni conduttimetriche non è necessario rilevare il valore della conduttanza al punto equivalente ma è sufficiente effettuare alcune misurazioni prima e dopo il punto stesso. Riportando in grafico i valori di conduttanza rilevati in funzione del titolante aggiunto si ottengono due rette che si intersecano al punto equivalente che può essere determinato per interpolazione.
Acido debole- base forte
Supponiamo di titolare l’acido debole HA con la base forte NaOH. In questo caso la conduttanza iniziale della soluzione è bassa data la natura dell’acido che, essendo un acido debole, libera pochi ioni H3O+ .L’aggiunta di titolante si ha la formazione della base coniugata dell’acido debole : all’inizio la formazione della base coniugata ci farebbe prevedere un aumento di conduttanza dovuto al maggior numero di ioni presenti in soluzione; tuttavia la presenza dello ione A– formatosi, anche se in concentrazione minima, fa retrocedere, per effetto di ione in comune, la dissociazione dell’acido debole HA e quindi la concentrazione idrogenionica della soluzione a cui è legato il valore della conduttanza iniziale. Si avrà pertanto una diminuzione iniziale della conduttanza.
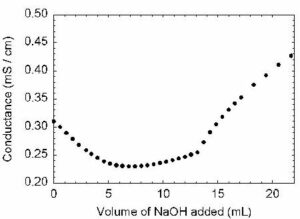 Con il procedere della titolazione la concentrazione degli ioni A– e dello ione Na+ aumenta in quantità tale da determinare un netto aumento della conduttanza: la curva di titolazione passa così per un minimo e successivamente riprende a salire.
Con il procedere della titolazione la concentrazione degli ioni A– e dello ione Na+ aumenta in quantità tale da determinare un netto aumento della conduttanza: la curva di titolazione passa così per un minimo e successivamente riprende a salire.
