Il saggio di Fehling, dovuto al chimico tedesco Hermann von Fehling, è un test molto utilizzato per la rilevazione degli zuccheri riducenti e non riducenti in una determinata soluzione. Il saggio di Fehling, complementare al saggio di Tollens chiamato anche “specchio d’argento”, può essere utilizzato anche per distinguere tra carboidrati idrosolubili e gruppi funzionali chetonici. Il saggio di Fehling può essere utilizzato sia per l’analisi qualitativa che quantitativa.
Gli zuccheri possono essere classificati come riducenti o non riducenti a seconda che possono ridurre alcuni reattivi in ambiente basico. Affinché uno zucchero possa essere classificato come riducente è necessario che esso possa esistere in una forma a catena aperta in cui è presente un gruppo carbonilico tipico delle aldeidi e dei chetoni che viene ridotto a gruppo carbossilico.

Nell’analisi qualitativa il saggio di Fehling consiste nell’aggiungere all’analita il reattivo di Fehling. Se la soluzione permane di colore blu l’esito è negativo mentre è positivo se la soluzione diventa di colore rosso.
Nell’analisi quantitativa il saggio di Fehling consiste nel misurare il volume di soluzione zuccherina necessario per la completa riduzione di un certo volume di reattivo di Fehling impiegando come indicatore il blu di metilene. Il saggio di Fehling viene eseguito riscaldando l’analita utilizzando la soluzione di Fehling.
Il saggio di Fehling viene effettuato oltre che nei laboratori chimici anche nelle strutture ospedaliere per rilevare la presenza di glucosio nelle urine nella diagnosi del diabete. Esso presenta tuttavia alcune limitazioni dovute al fatto che aldeidi aromatiche non possono essere rilevate da questo test.
Inoltre poiché la reazione avviene in un ambiente alcalino mentre se l’ambiente è acido, gli ioni rame sono stabili e non si ossidano.
Reattivo di Fehling
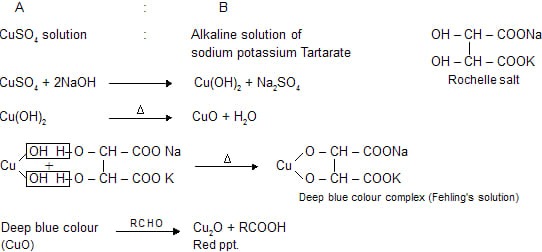
Il reattivo di Fehling è preparato unendo due soluzioni dette rispettivamente Fehling A e Fehling B. La soluzione Fehling A è costituita da solfato di rame (II) di colore blu, mentre la soluzione Fehling B è costituita da una soluzione alcalina di NaOH contenente tartrato di sodio e potassio detto sale di Rochelle che è incolore.
Per la preparazione del reattivo di Fehling A si solubilizzano circa 7 g di CuSO4 ·7 H2O in 100 mLdi acqua. Per la preparazione del reattivo di Fehling B si solubilizzano circa 24 g di KOH e circa 34.6 g di tartrato di sodio e potassio in 100 mL di acqua.

Queste due soluzioni, sono stabili e vengono combinate durante il saggio di Fehling in quanto il complesso di rame (II) formato dalla loro combinazione non è stabile e si decompone in condizioni alcaline con formazione di idrossido di rame (II).
In questa miscela finale ottenuta mescolando volumi uguali delle due soluzioni, gli ioni tartrato acquosi del sale di Rochelle disciolto fungono da chelanti nei confronti degli ioni Cu2+ presenti nella soluzione Fehling A dovuti ai cristalli di solfato di rame disciolti, con formazione del complesso solubile bistartratocuprato (II). Questo complesso fornisce ioni rameici Cu2+ che, nel corso del saggio di Fehling, e si riducono ad ossido di rame (I) dando un precipitato rosso.
Il reattivo di Fehling può essere utilizzato nell’analisi qualitativa per distinguere le aldeidi dai chetoni in quanto le aldeidi si ossidano mentre i chetoni non vanno incontro all’ossidazione a meno che non si tratti di α idrossichetoni.
Il reattivo di Fehling viene inoltre utilizzato nella scomposizione dell’amido che viene decomposto in glucosio e maltodestrine che hanno proprietà funzionali diverse a seconda del tipo di amido da cui sono composte e del grado di idrolisi.
Reazioni nel saggio di Fehling
L’impiego delle soluzioni rameiche permette di riconoscere gli zuccheri aventi libera una funzione aldeidica o chetonica che, direttamente o per isomerizzazione a caldo e in soluzione alcalina, riducono il sale rameico, facendo precipitare il caratteristico ossido di rame (I), rosso, mentre gli zuccheri si ossidano ad acidi carbossilici.
Avviene quindi una reazione di ossidoriduzione, in cui il sale rameico che costituisce l’agente ossidante, si riduce reagendo con gli zuccheri riducenti, con il rame che precipita sotto forma di ossido rameoso. La reazione che avviene è:
RCHO (aq) + 2 Cu2+(aq) + 5 OH– (aq) → RCOO–(aq) + Cu2O(s) + 3 H2O(l)
Tuttavia, man mano che, nel corso della titolazione, la quantità di Cu2+ nella soluzione diminuisce, diventa difficile individuare il punto di equivalenza effettivo.
Per compensare questa problematica, dopo che la maggior parte del blu del complesso Cu2+ è scomparsa, viene aggiunto l’indicatore blu di metilene che è un colore blu intenso nella sua forma ossidata ma incolore se esposto ad agenti riducenti. Dopo che il titolante costituito, ad esempio da glucosio ha completamente ridotto tutto il Cu2+ a Cu+, il blu di metilene sarà ridotto dal glucosio, con scomparsa del colore blu dalla soluzione e ciò indica il punto finale della titolazione.
Procedura
Preparare una soluzione standard di glucosio pesando con accuratezza circa 2.5 g di glucosio, solubilizzare in acqua distillata e portare a volume a 500 mL in un matraccio. Mettere tale soluzione in una buretta.
Unire 10.0 mL di soluzione del reattivo di Fehling A con 10.0 mL di soluzione del reattivo di Fehling B in una beuta e aggiungere circa 30 mL di acqua distillata. Mettere la beuta su una piastra riscaldante a calore medio senza mai oltrepassare la temperatura di 70°C e iniziare la titolazione fin quando inizia a scomparire la colorazione blu e inizia a formarsi un precipitato rosso.
Aggiungere 1 o 2 gocce di blu di metilene (soluzione acquosa all’1%) e continuare la titolazione fin quando scompare del tutto la colorazione blu scompare e la soluzione appare incolore. Conoscendo la concentrazione della soluzione di glucosio e il volume utilizzato per la titolazione si conoscono le moli e quindi la massa di glucosio utilizzata per titolare 20 mL della soluzione di Fehling e quindi la massa di glucosio per titolare 1 mL della soluzione di Fehling.
La determinazione della concentrazione della soluzione incognita va fatta con la stessa procedura mettendo nella buretta il campione incognito.
