Una soluzione tampone è costituita da un acido debole e dalla sua base coniugata ad esempio acido acetico/ acetato o da una base debole e il suo acido coniugato ad esempio ammoniaca/ammonio.
La caratteristica delle soluzioni tampone è che il pH di tali soluzioni rimane pressoché invariato in seguito all’aggiunta di piccole quantità di acido forte o base forte.
Varie sono le definizioni del potere tamponante ed ognuna ha la sua valenza e aiuta a comprendere meglio il concetto. La capacità tamponante può essere definita come la massima quantità di acido o base forte che può essere aggiunta alla soluzione tampone prima che si verifichi una significativa variazione di pH. Quest’ultima definizione, tuttavia, è troppo generica per quanto attiene la mancata quantificazione di variazione significativa di pH. Infatti dipende dal campo in cui si sta lavorando: mentre la variazione di 1 unità di pH può non destare problemi, in taluni casi, e specialmente nei sistemi biologici, anche una variazione di 0.1 unità di pH può costituire una variazione significativa.
La capacità tamponante può essere definita anche come la quantità di acido o base forte che deve essere aggiunta a un litro di soluzione affinché si verifichi la variazione di un’unità di pH.
Tale definizione, sebbene trovi applicazioni pratiche fornisce valori diversi di potere tamponante a seconda che si aggiunga, alla soluzione tampone un acido o una base a meno che la soluzione non sia equimolecolare e il suo pH sia quindi uguale al pKa e ciò contraddice l’ipotesi per la quale la resistenza che una soluzione tampone oppone ad aggiunta di piccole quantità di acido o di base forti sia identica a prescindere se sia stato aggiunto un acido o una base.
L’equazione analitica che definisce il potere tamponante è:
β = dn/dpH (1)
Dove n è il numero di equivalenti di base forte aggiunti. L’aggiunta di dn moli di acido varierà in pH dello stesso valore ma con segno opposto.
Si assuma che la base forte sia monoprotica e che il volume della soluzione tampone sia pari a 1.00 L il che rende possibile l’uguaglianza tra numero di moli e molarità.
Bilancio di carica
Il bilancio di carica della soluzione è espresso dalla relazione:
[A–] + [OH–] = [B+] + [H+] (2)
essendo [B+] la concentrazione della base forte presente (o, essendo il volume pari a 1.00 L il numero di moli della base forte) in soluzione e quindi rappresenta il valore di n presente nell’equazione (1).
La concentrazione totale della soluzione tampone Cbuff (dall’inglese buffer che significa tampone) è data da:
Cbuff = [HA] + [A–] (3)
L’espressione della costante acida è data da:
Ka = [H+][A–] / [HA] da cui:
[HA] = [H+][A–]/ Ka (4)
Sostituendo il valore di [HA] nell’equazione (3) si ha:
Cbuff = [H+][A–]/ Ka + [A–] (5)
Mettendo [A–] in evidenza si ha:
Cbuff = [A–] ([H+] / Ka + 1) = [A–] ( [H+] + Ka / Ka)
Da cui;
[A–] = Cbuff Ka/ [H+] + Ka (6)
Dal prodotto ionico dell’acqua Kw = [H+][OH–] si ha [OH–] = Kw/ [H+]
Riscriviamo la (2) sostituendo a [B+] il valore n
[A–] + [OH–] = n + [H+]
Isoliamo n:
n = [A–] + [OH–] – [H+]
sostituiamo ad [A–] il valore ricavato nella (6) e a [OH–] il valore ricavato dal prodotto ionico dell’acqua. Si ottiene:
n = Cbuff Ka/ [H+] + Ka + Kw/ [H+] + [H+] (7)
calcoliamo la derivata:
β = dn / dpH = dn d[H+] / d [H+] d pH (8)
β = ( – Kw/ [H+]2 – 1 – Cbuff Ka/ (Ka + [H+])2 ( – 2.303 [H+] (9)
infine il potere tamponante è dato dall’equazione:
β = 2.303 ( Kw/ [H+] + [H+] + Cbuff Ka[H+] / (Ka + [H+])2) (10)
in figura viene rappresentato il potere tamponante di una soluzione 5 mM di acido acetico in funzione del pH. La curva superiore è quella misurata, quella inferiore è quella teorica.
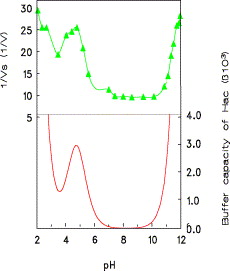
Come ci si aspetta la capacità tamponante mostra un picco al valore di pH corrispondente a 4.74 che è il valore del pKa dell’acido acetico. Si può notare inoltre che il potere tamponante presenta valori alti per valori di pH prossimi a pKa in accordo con il fatto che una soluzione tampone esplica il suo potere tamponante quando la concentrazione dell’acido e della sua base coniugata sono simili.
Un esempio semplice di determinazione del potere tamponante è costituito dal seguente esempio:
sia dato di calcolare il potere tamponante quando 0.2 moli di HCl vengono aggiunte a 1 L di una soluzione di ammoniaca e il valore di pH scende da 9.5 a 8.9
In questo caso ΔpH = 9.5 – 8.9 = 0.6
n = 0.2/ 1 L = 0.2 M
β = 0.2/ 0.6 = 0.33 M
