Gli indicatori sono utilizzati nelle titolazioni che costituiscono un potente e valido mezzo nell’ambito dell’analisi chimica quantitativa.
Gli indicatori sono specie in grado di fornire un distinto e apprezzabile cambiamento quando variano le condizioni in una soluzione senza modificare la composizione della soluzione né reagire con alcun componente.
A seconda dell’analita le titolazioni possono essere di diversi tipi e per ognuna di esse viene individuato quale è l’indicatore più idoneo.
Tra le titolazioni più comuni si annoverano le titolazioni:
Indicatori acido base
Nel caso di titolazioni acido-base l’indicatore è costituito da un acido debole o da una base debole che assume un colore diverso a seconda del pH.
Le titolazioni acido-base possono essere fatte utilizzando un:
- acido forte e una base forte
- acido debole e una base forte
- base debole e un acido forte si comprende che
Il punto equivalente a seconda della forza dell’acido o della base si raggiunge a diversi valori di pH.
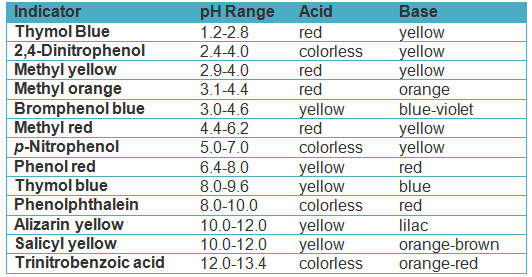
Pertanto ci si avvale di indicatori che mostrano una variazione di colore a seconda del pH a cui avviene il viraggio. In tabella vengono riportati alcuni degli indicatori più comuni e il range di pH a cui avviene il viraggio.
Indicatori redox
Gli indicatori acido-base presentano una colorazione diversa a seconda se sono o meno dissociati.
Gli indicatori redox hanno invece una diversa colorazione . Essa varia a seconda se gli indicatori sono nello stato ossidato o ridotto.
L’indicatore deve presentare un potenziale di ossidazione intermedio tra quello del titolante e quello dell’analita mostrando una variazione di colore netta e facilmente rilevabile con una variazione del potenziale elettrodico in prossimità del punto equivalente:
Indicatori nelle titolazioni complessometriche
Le titolazioni complessometriche sono utilizzate per la determinazione della concentrazione di un catione presente in soluzione se questo può formare un complesso con un determinato chelante che, nella maggior parte dei casi, è l’EDTA e gli indicatori abitualmente utilizzati sono quelli metallocromici.
Tra gli indicatori metallocromici i più usati sono il Nero Eriocromo T (NET) utilizzabile nell’intervallo di pH 6-12 e la muresside. Quest’ultima è utilizzabile a valori di pH maggiori di 12 per determinazione del calcio in cui dà un viraggio da rosso a viola .
Per la determinazione di Co2+, Cu2+e di Ni2+ l’intervallo di pH va da 7 a 11 in cui dà un viraggio da arancio a viola.
Indicatori nelle titolazioni per precipitazione
Nelle titolazioni per precipitazione sono utilizzati agenti precipitanti per la determinazione della concentrazione dell’analita.
Le titolazioni per precipitazione più comuni sono la determinazione dei cloruri secondo il metodo di Mohr in cui il titolante è il nitrato di argento è l’indicatore è il cromato di potassio.
Secondo il metodo di Mohr, per l’indicazione del punto finale della titolazione si sfrutta la precipitazione del cromato d’argento, di colore rosso mattone.
Sempre per la determinazione degli alogenuri può essere utilizzato il metodo di Volhard in cui un eccesso noto della soluzione standard di nitrato di argento viene aggiunto alla soluzione contenente l’analita.
Lo ione Ag+ in eccesso viene retrotitolato con tiocianato con cui tali ioni formano un precipitato di tiocianato di argento di colore bianco.
In tal caso l’indicatore è un sale di Ferro (III) come allume ferrico o nitrato ferrico. Quando tutto lo ione argento ha reagito l’ulteriore aggiunta di tiocianato porta alla formazione di un complesso con lo ione Fe3+ di colore rosso mattone.
Nel metodo Fajans gli ioni cloruro sono determinati utilizzando un indicatore di adsorbimento ovvero un colorante organico che è adsorbito o desorbito dal solido prodotto dalla precipitazione, tale fenomeno comporta un cambiamento di colore o un trasferimento di colore dalla soluzione al precipitato o viceversa. L’indicatore usato è in genere la fluoresceina che con l’argento forma il fluorescinato di argento di colore rosso che evidenzia il punto finale della titolazione.